摘要:16.如图所示.某学生设计了如下实验来验证质量守恒定律:在锥形瓶里加入稀盐酸.气球中放入纯碱.将锥形瓶放在天平上.使天平两边平衡.然后轻轻将纯碱倒入稀盐酸中.此反应生成NaCl.CO2 和一种相对分子质量最小的氧化物.该反应的化学方程式为▲ .假设你的天平灵敏度很高.反应后天平 ▲ 继续保持平衡.其原因是 ▲ .
网址:http://m.1010jiajiao.com/timu3_id_3936624[举报]
某学生设计了以下实验方案,探究铜和一定量(10mL)浓HNO3反应中是否产生NO气体,实验装置如图所示(装置的气密性良好),请回答下列问题:
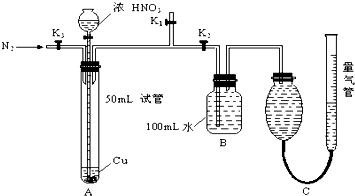
(1)在反应前通入N2的作用是 ,进行这步操作时应关闭 而打开 (填K1、K2、K3).
(2)反应结束后,通过分液漏斗向试管中加40mL蒸馏水,再从B装置所得100mL溶液中取出25.00mL,加2滴酚酞试液,用0.1000mol/L的NaOH溶液滴定,当滴定完成后消耗NaOH溶液18.00mL,则B容器中所得HNO3的物质的量是 ,B中生成硝酸的同时会生成NO mL(标准状况).
(3)用C装置读取排出水的体积时,应注意 、 .
(4)若不考虑实验前后导管中的气体,C装置的气体中至少含N2 mL.若由C装置测得所收集到的气体体积为143.0mL(已折算成标准状况),请你判断铜和一定量浓HNO3反应过程中是否有NO生成?如果有,写出判断的依据;如果没有,写出理由. .
查看习题详情和答案>>

(1)在反应前通入N2的作用是
(2)反应结束后,通过分液漏斗向试管中加40mL蒸馏水,再从B装置所得100mL溶液中取出25.00mL,加2滴酚酞试液,用0.1000mol/L的NaOH溶液滴定,当滴定完成后消耗NaOH溶液18.00mL,则B容器中所得HNO3的物质的量是
(3)用C装置读取排出水的体积时,应注意
(4)若不考虑实验前后导管中的气体,C装置的气体中至少含N2
 某学生设计了如图所示的装置进行实验,各装置中所装试剂、实验操作及实验现象如下:
某学生设计了如图所示的装置进行实验,各装置中所装试剂、实验操作及实验现象如下:Ⅰ.装置中所装的试剂是:①A瓶装无水乙醇,内放无水盐X;②B干燥管中装生石灰;③C和D中都装浓硫酸;④E瓶中装入试剂Y
Ⅱ.实验操作及现象是:用水浴加热A瓶;将D中浓硫酸缓缓滴入E中与试剂Y作用;发现C中导管有大量气泡放出;A瓶内X逐渐变色,从B管挥发出的气体可点燃.
请回答下列问题:
(1)E瓶中所装的试剂Y是
c
c
(填写编号)a.饱和食盐水 b.MnO2和NaCl的混合物 c.浓盐酸
(2)C中浓H2SO4所起的作用是
干燥HCl气体
干燥HCl气体
,D瓶中浓H2SO4所起的作用是吸收浓盐酸中混有的水分,浓H2SO4溶于水放热,有利于HCl气体逸出
吸收浓盐酸中混有的水分,浓H2SO4溶于水放热,有利于HCl气体逸出
.(3)A瓶中发生反应的化学方程式是
CH3CH2OH+HCl
CH3CH2Cl+H2O
| △ |
CH3CH2OH+HCl
CH3CH2Cl+H2O
,反应类型是| △ |
取代反应
取代反应
,所生成的氯乙烷
氯乙烷
(写名称)在B出口处点燃.(4)无水盐X宜选用
无水CuSO4
无水CuSO4
,它能起指示剂作用的原因是实验过程中观察到无水CuSO4由白变蓝,说明反应中有水生成,与CuSO4结合生成CuSO4?5H2O
实验过程中观察到无水CuSO4由白变蓝,说明反应中有水生成,与CuSO4结合生成CuSO4?5H2O
.(5)此实验能证明乙醇分子中含有氧原子的理由是
无水CuSO4变蓝证明了反应中一定有水生成,水中的氧元素不能来自于HCl,故只能由乙醇提供
无水CuSO4变蓝证明了反应中一定有水生成,水中的氧元素不能来自于HCl,故只能由乙醇提供
.(6)如果将装置中的C瓶去掉,实验目的是否能够达到?
不能
不能
(填“能”或“不能”),因为HCl挥发时带出水蒸气,若不除去,无法判定使无水CuSO4变蓝的水是否来自于乙醇
HCl挥发时带出水蒸气,若不除去,无法判定使无水CuSO4变蓝的水是否来自于乙醇
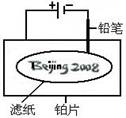
.某学生设计了如图所示的“黑笔写红字”的趣味实验。滤纸上先用NaCl和无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹——“ ”。
”。
据此,下列叙述不正确的是( )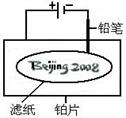
| A.铅笔作阴极:电极反应为:2H+ + 2e- = H2↑ |
| B.铂片作阳极:电极反应为:2Cl-- 2e- = Cl2↑ |
| C.铅笔与滤纸接触处有少量Cl2逸出 |
D.上述反应总的离子方程式可表示为2Cl-+2H2O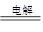 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
某学生设计了如图所示的“黑笔写红字”的趣味实验。滤纸上先用NaCl和无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹——“ ”。
”。
据此,下列叙述不正确的是( )
A.铅笔作阴极:电极反应为:2H+ + 2e- = H2↑
B.铂片作阳极:电极反应为:2Cl- - 2e- = Cl2↑
C.铅笔与滤纸接触处有少量Cl2逸出
D.上述反应总的离子方程式可表示为2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
查看习题详情和答案>>
如图所示,某同学设计了一个燃料电池并探究氯碱工业的原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
(1)甲烷燃料电池负极反应式为________________________。
(2)石墨(C)极的电极反应式为_______________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成的气体的体积为________L;丙装置中阴极析出铜的质量为________ g。
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。
若用于制漂白液,a为电池的________极,电解质溶液最好用)________________
若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用________作电极。