网址:http://m.1010jiajiao.com/timu3_id_393638[举报]
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是 。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是 。
A.Mg2+B.Fe2+??????????????????? C.Al3+D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:

回答下列问题:
①操作Ⅰ的名称是 ,操作Ⅱ的名称是 。
②写出在空气中煅烧FeCO3的化学方程式 。
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定。
a.称取2.850 g绿矾(FeSO4·7H2O)产品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液放入锥形瓶中;
c.用硫酸酸化的0.010 00 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 。
②某同学设计的下列滴定方式,最合理的是 。(夹持部分略去)(填字母序号)

③写出滴定过程中反应的离子方程式: 。
④计算上述样品中FeSO4·7H2O的质量分数为 。
查看习题详情和答案>>
| 实验 序号 |
时间 浓度 温度 |
0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
| A、前10分钟,实验4的平均化学反应速率比实验1的大 |
| B、实验2可能使用了催化剂 |
| C、C>1.0 |
| D、实验3比实验2先达到化学平衡状态 |
(14分)某校化学课外活动小组利用下面所提供的仪器装置和药品制取NaHCO3溶液,设计如下实验。实验室提供的药品、仪器装置如下:
药品:①2%NaOH溶液 ②稀HCl ③稀H2SO4 ④饱和KHCO3溶液 ⑤浓H2SO4 ⑥CaCO3固体 ⑦K2CO3粉末
仪器装置(如图所示):
请根据题目要求回答下列问题: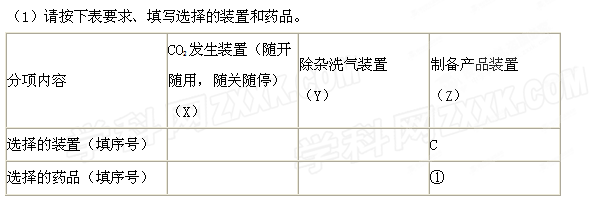
(2)如何检验所选择的CO2发生装置(X)的气密性,请写出主要操作过程: 。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为 ,Y装置中除去的杂质为 。
(4)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其原因是 ;通入 过量CO2后,Z装置内的溶液中离子浓度大小顺序为 ;若要保证乙装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过 %(质量分数)。
过量CO2后,Z装置内的溶液中离子浓度大小顺序为 ;若要保证乙装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过 %(质量分数)。
附:有关物质在常温(20℃)时的溶解度
| 化学式 | Na2CO3 | NaHCO3 | NaOH | NaCl | Na2SO4 |
| 溶解度(g/100gH2O) | 21.3 | 9.60 | 107 | 35.8 | 19.4 |
药品:①2%NaOH溶液 ②稀HCl ③稀H2SO4 ④饱和KHCO3溶液 ⑤浓H2SO4 ⑥CaCO3块状固体 ⑦K2CO3粉末?
仪器装置(如图所示):?

若用X代表制备过程中可随开随用的气体发生装置图,Y代表除杂洗气装置,Z代表制备产品的装置。试按要求回答下列问题:?
(1)制取CO2气体的发生装置图可选用 ;但要使制备过程做到随开随用,只能选用 。(填字母编号)?
(2)除杂装置可选用 (填字母编号),装置内的试剂应选用 (填序号),除去的杂质为 (填化学式)。?
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为? ? 。?
(4)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其目的是 ;若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过 %(质量分数)。(小数点后保留1位有效数字)
附:有关物质在常温(20 ℃)时的溶解度?
化学式 | Na2CO3 | NaHCO3 | NaOH | NaCl | Na2SO4 |
溶解度(g/100 g) | 21.3 | 9.6 | 107 | 35.8 | 19.4 |
A、B、D、E 四种短周期元素,其原子序数逐渐增大。A 元素原子的核外电子数、电子层数和最外层电子数均相等,B、D、E 三种元素在周期表中相对位置如图①所示,E 的单质能与水反应生成两种酸。甲、乙、M、W、X、Y、Z 七种物质均由A、B、D 三种元素中的一种或几种组成,其中只有M 分子同时含有三种元素;W 为A、B 两元素组成的18 电子分子,可做火箭燃料;甲、乙为非金属单质;X 分子含有10个电子。它们之间的转化关系如图②。

回答下列问题:
(1)Z的化学式为 。
(2)E 的单质与水反应的离子方程式为 。
(3)W—空气燃料电池是一种碱性燃料电池,电解质溶液是20% ~30%的KOH溶液。W—空气燃料电池放电时,负极反应式为 。
(4)将一定量的A2、B2 的混合气体放入2L密闭容器中,在500°C、2°C×107 Pa下达到平衡。测得平衡气体的总物质的量为0.5mol,其中A2 为0.3mol,B2 为0.1mol。则该条件下A2 的平衡转化率为 ,该温度下反应2BA3(g ) ![]() 3A2(g)+B2(g)的平衡常数为 。
3A2(g)+B2(g)的平衡常数为 。