摘要:24.在 763 K 3.04×104 kPa 时.用CO和H2为原料合成CH3OH.存在下列平衡: CO(g)+2H2(g)CH3OH(g) 当原料中H2和CO的比例不同时.对CO的转化率及平衡混合物中甲醇的体积分数都有影响. m α y 1 0.25 2 0.45 3 19.35% ⑴设H2和CO的起始物质的量之比为m.平衡时CO的转化率为α.平衡混合物中甲醇的体积分数为y.试推断m.α.y三者的相互关系.并以y=f (α.m)的函数表达式表示出来: . ⑵将右表已知数据代入你导出的表达式中进行计算.把计算结果填入右表中有关空格栏中: ⑶根据上表数据.判断用CO和H2合成甲醇时.H2和CO的最佳体积比是 .
网址:http://m.1010jiajiao.com/timu3_id_393140[举报]
(10分)在实验室里,某同学取一小块金属钠做与水反应的实验。试完成下列问题:
(1)切开的金属钠暴露在空气中,最先观察到的现象是 ,所发生反应的化学方程式是 。
(2)将钠投入水中后,钠融化成一个小球,根据这一现象你能得出的结论是
① ,② 。
将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是
| A.有气体生成 | B.钠融化成小球并在液面上游动 |
| C.溶液底部有银白色的金属钙生成 | D.溶液变浑浊 |
在反应过程中,若生成标准状况下224mL的H2,则转移的电子的物质的量为 。
(4)根据上述实验过程中钠所发生的有关变化,试说明将金属钠保存在煤油中的目的是
。 查看习题详情和答案>>
(10分)在常温常压下,都用惰性材料作电极.分别电解(同浓度、同体积、通过相同电量)下列溶液:
| A.CuSO4 | B.AgNO3 | C.KOH | D.H2SO4 E.NaCl F.Na2SO4 |
(1)在A中一个电极上质量增加了0.128 g,在B中一个电极上质量增加 ,增加的物质是 .
(2) 在一极产生O2,同时另一极产生H2(填写序号,下同).
(3) 电解后,溶液中的C(OH-)增大
(4) 电解后,溶液的pH减小.
(5) 电解后,溶液的浓度增大而[H+]不变. 查看习题详情和答案>>
(10分)在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应H2(g)+I2(g) 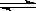 2HI(g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
2HI(g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
(1)升高温度 ;(2)加入催化剂 ;
(3)充入更多的H2 ;(4)扩大容器的体积 ;
(5)容器容积不变,通入氖气 。
 PCl5(g) 反应达到平衡时容器的压强为开始时的6/7,则此时。
PCl5(g) 反应达到平衡时容器的压强为开始时的6/7,则此时。