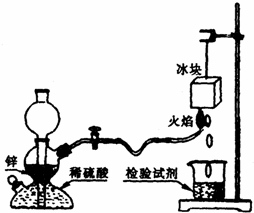
摘要:氢气在空气中燃烧生成水:2H2+O2=2H2O.这是人人皆知的常识.但有同学会提出:氢气在空气中燃烧会不会生成H2O2:H2+O2=H2O2 ? 根据我们的经验.H2O2不稳定.即便是有少量H2O2生成.也会因火焰的高温而分解.某课外兴趣小组设计了如下图“验证H2在空气中燃烧的产物中是否含有H2O2 的实验装置.试填空: ⑴甲同学从下列试剂中选择了一种检验试剂.成功检测到了H2O2的存在.该试剂是( ) A.淀粉溶液 B.氯化钠溶液 C.氢氧化钠溶液 D.淀粉碘化钾酸性溶液 甲同学检验时证明有H2O2产生的实验现象是 .冰块的作用是 . ⑵乙同学用较稀的酸性高锰酸钾溶液作为检验试剂.实验时观察到高锰酸钾溶液褪色(生成Mn2+).由此也证明了氢气燃烧有H2O2产生.写出该反应的离子方程式: . ⑶丙同学对乙同学的检验方案提出质疑,若锌粒中杂质与稀硫酸反应有少量H2S.SO2等气体生成.也会使高锰酸钾溶液褪色.从而导致错误的判断.为消除丙同学的疑虑.请你提出对上述实验装置的改进建议:
网址:http://m.1010jiajiao.com/timu3_id_392780[举报]
| |||||||||||||||
Ⅰ.氢气是一种清洁能源.
(1)已知 2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol;2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
①表示氢气燃烧热的热化学方程式是
②燃烧2g H2生成水蒸气,放出的热量为
(2)人们可以通过多种途径获取氢气.14g CO与适量水蒸气反应生成CO2和H2,需放出20.5kJ热量,此反应的热化学方程式为
Ⅱ.煤是化石燃料.煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后是使得到的氢气和一氧化碳在充足的空气中燃烧.这两个过程的化学方程式为:
a.C(s)+O2(g)=CO2(g)△H=E1 ①
b.C(s)+H2O(g)=CO(g)+H2(g)△H=E2 ②
H2(g)+
O2(g)=H2O(g)△H=E3 ③
CO(g)+
O2(g)=CO2(g)△H=E4 ④
请回答:(1)上述四个热化学方程式中哪个反应△H>0?
(2)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是
A.a比b多 B. a比b少 C.a与b在理论上相同
Ⅲ.已知:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ/mol
N2(g)+2H2(g)+
Cl2(g)═NH4Cl(s)△H=-313.6kJ/mol
计算NH3(g)+HCl(g)═NH4Cl(s)的反应焓变:△H=
查看习题详情和答案>>
(1)已知 2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol;2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
①表示氢气燃烧热的热化学方程式是
H2+
O2=H2O(l)△H=-285.8kJ/mol
| 1 |
| 2 |
H2+
O2=H2O(l)△H=-285.8kJ/mol
| 1 |
| 2 |
②燃烧2g H2生成水蒸气,放出的热量为
241.8
241.8
kJ.(2)人们可以通过多种途径获取氢气.14g CO与适量水蒸气反应生成CO2和H2,需放出20.5kJ热量,此反应的热化学方程式为
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol
.Ⅱ.煤是化石燃料.煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后是使得到的氢气和一氧化碳在充足的空气中燃烧.这两个过程的化学方程式为:
a.C(s)+O2(g)=CO2(g)△H=E1 ①
b.C(s)+H2O(g)=CO(g)+H2(g)△H=E2 ②
H2(g)+
| 1 |
| 2 |
CO(g)+
| 1 |
| 2 |
请回答:(1)上述四个热化学方程式中哪个反应△H>0?
②
②
(填序号)(2)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是
C
C
. A.a比b多 B. a比b少 C.a与b在理论上相同
Ⅲ.已知:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ/mol
| 1 |
| 2 |
| 1 |
| 2 |
计算NH3(g)+HCl(g)═NH4Cl(s)的反应焓变:△H=
-175.1kJ/mol
-175.1kJ/mol
.