摘要:I.粗盐经提纯后得到NaCl溶液.再经蒸发.结晶.烘干得精盐. ①蒸发操作中使用到的仪器除铁架台外,还需要仪器的名称为 ▲ . ②该同学将所得精盐配成溶液.用于另一实验.实验中需要用60 mL 1 mol/L-1的NaCl溶液.配制过程中用托盘天平称取的精盐质量为 ▲ .配制该溶液所需的主要仪器是 ▲ . II. 某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数.实验室按以下步骤进行: ① 称取a g样品.置于烧杯中, ② 加入适量盐酸和适量蒸馏水.使样品溶解.然后准确配制成250mL溶液, ③ 准确量取25.00mL步骤②中配得的溶液.置于烧杯中.加入适量的氯水.使反应完全, ④ 加入过量氨水.充分搅拌.使沉淀完全, ⑤ 过滤.洗涤沉淀, ⑥ 将沉淀转移到坩埚内.加热.搅拌.直到固体由红褐色全部变为红棕色后.在干燥器中冷却至室温后.称量, ⑦--. 请根据上面叙述.回答: (1)上图所示仪器中.本实验步骤①②③中必须用到的仪器是E和 . (2)写出步骤③中发生反应的离子方程式 (3)洗涤沉淀的操作是 (4)第⑥步的操作中.将沉淀物加热.冷却至室温.称量其质量为m1g.再次加热并冷却至室温称量其质量为m2g.若m1与m2差值较大.接下来的操作应当是 .
网址:http://m.1010jiajiao.com/timu3_id_392012[举报]
我国柴达木盆地拥有丰富的盐矿资源,液体矿床以钾矿为主,伴生着镁、溴等多种矿产.工业上取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),工业流程如图1:

请根据以上流程,回答相关问题:
(1)操作①需要的玻璃仪器有 .
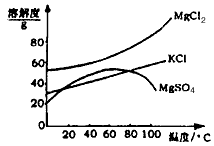
(2)参照图2溶解度曲线,有人认为固体B是氯化钾,有人说是氯化镁,请说出你的观点和支撑你观点的理由: .
(3)同学甲模仿实验室中粗盐提纯的操作,对上述操作②后无色液体设计了除杂提纯实验方案,也可制得较纯净的氯化钾晶体.其方案流程如下:

有关资料:
(i)该方案中的无色溶液就是操作②后无色液体,混合液A的主要成分是 .(填化学式)有人认为用一种试剂 (填化学式)就可以起到混合液A的作用,你的观点是 .
(ii)有同学提出从经济上考虑可以用石灰乳代替试剂A进行实验,经讨论,其他同学一致认为该提议不可行,他们的理由是 .
(ⅲ)实验过程中,若要确保Mg2+完全除尽,用广泛pH试纸测定溶液的pH应≥ .(若离子浓度小于10-5mol?L-1可视作已被完全除尽).
(ⅳ)对溶液B加热并不断滴加1 mol?L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C.由溶液C得到固体C的操作名称是 .
(v)工业流程中也可以获得氯化镁的溶液,从中可以提取金属材料镁.方法是:加热蒸发氯化镁的溶液得到MgCl2?6H2O,在 中加热使其失去结晶水得到MgCl2,电解就可以得到金属镁.
查看习题详情和答案>>

请根据以上流程,回答相关问题:
(1)操作①需要的玻璃仪器有
(2)参照图2溶解度曲线,有人认为固体B是氯化钾,有人说是氯化镁,请说出你的观点和支撑你观点的理由:
(3)同学甲模仿实验室中粗盐提纯的操作,对上述操作②后无色液体设计了除杂提纯实验方案,也可制得较纯净的氯化钾晶体.其方案流程如下:

有关资料:
| 化学式 | Ca(OH)2 | CaSO4 | BaCO3 | BaSO4 | MgCO3 | Mg(OH)2 |
| Ksp | 1.0×10一4 | 7.1×10一5 | 8.1×10一9 | 1.08×10一10 | 3.5×10一5 | 1.6×10一11 |
(ii)有同学提出从经济上考虑可以用石灰乳代替试剂A进行实验,经讨论,其他同学一致认为该提议不可行,他们的理由是
(ⅲ)实验过程中,若要确保Mg2+完全除尽,用广泛pH试纸测定溶液的pH应≥
(ⅳ)对溶液B加热并不断滴加1 mol?L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C.由溶液C得到固体C的操作名称是
(v)工业流程中也可以获得氯化镁的溶液,从中可以提取金属材料镁.方法是:加热蒸发氯化镁的溶液得到MgCl2?6H2O,在
我国柴达木盆地拥有丰富的盐矿资源,液体矿床以钾矿为主,伴生着镁、溴等多种矿产。工业上取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),工业流程如下
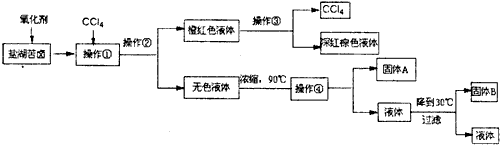
请根据以上流程,回答相关问题:
(1)操作①需要的玻璃仪器有__________________。
(2)参照下图溶解度曲线,有人认为固体B是氯化钾,有人说是氯化镁,请说出你的观点和支撑你观点的理由:____________________________
(1)操作①需要的玻璃仪器有__________________。
(2)参照下图溶解度曲线,有人认为固体B是氯化钾,有人说是氯化镁,请说出你的观点和支撑你观点的理由:____________________________
(3)同学甲模仿实验室中粗盐提纯的操作,对上述操作②后无色液体设计了除杂提纯实验方案,也可制得较纯净的氯化钾晶体。其方案流程如下
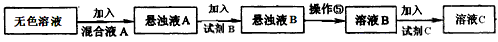
有关资料:
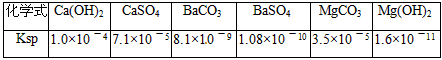
(i)该方案中的无色溶液就是操作②后无色液体,混合液A的主要成分是___________。(填化学式)有人认为用一种试剂__________________(填化学式)就可以起到混合液A的作用,你的观点是____________________________________。
(ii)有同学提出从经济上考虑可以用石灰乳代替试剂A进行实验,经讨论,其他同学一致认为该提议不可行,他们的理由是______________________。
(ⅲ)实验过程中,若要确保Mg2+完全除尽,用广泛pH试纸测定溶液的pH应≥__________。(若离子浓度小于10-5mol·L-1可视作已被完全除尽)。
(ⅳ)对溶液B加热并不断滴加l mol·L-1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C。由溶液C得到固体C的操作名称是__________________。
(ⅴ)工业流程中也可以获得氯化镁的溶液,从中可以提取金属材料镁。
方法是:加热蒸发氯化镁的溶液得到MgCl2·6H2O,在_______中加热使其失去结晶水得到MgCl2,电解就可以得到金属镁。
查看习题详情和答案>>
(ii)有同学提出从经济上考虑可以用石灰乳代替试剂A进行实验,经讨论,其他同学一致认为该提议不可行,他们的理由是______________________。
(ⅲ)实验过程中,若要确保Mg2+完全除尽,用广泛pH试纸测定溶液的pH应≥__________。(若离子浓度小于10-5mol·L-1可视作已被完全除尽)。
(ⅳ)对溶液B加热并不断滴加l mol·L-1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C。由溶液C得到固体C的操作名称是__________________。
(ⅴ)工业流程中也可以获得氯化镁的溶液,从中可以提取金属材料镁。
方法是:加热蒸发氯化镁的溶液得到MgCl2·6H2O,在_______中加热使其失去结晶水得到MgCl2,电解就可以得到金属镁。