摘要:21A.[物质结构与性质] (1)甲.乙两种元素是同一周期的相邻元素.甲元素是形成有机物的主要元素.乙元素的p亚层上有3个电子. ①写出甲元素的电子排布式 .下列各化合物分子中甲元素的原子杂化方式全部相同的是 . ②甲.乙元素可形成硬度大于金刚石的一种化合物.该化合物属于 晶体.其化学式为 . (2)人们一直致力于人工固氮的研究以获得廉价的氮肥.科学家先后提出并合成了出固氮酶的多种模拟物.其中一类是含Mo.Fe.S原子的类立方体结构.如下图所示. 图中左右两边对称.各含一个近似为立方体的结构.每个立方体含有4个Fe原子.4个S原子.它们位于立方体的8个顶点.且原子间只有一种化学键. ①请在图中左边立方体的○中填写出其余3个Fe原子. ②上述一个立方体中4个Fe原子所在的顶点连接所构成的空间几何体为 . 21B.[实验化学] 市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象.上层为无色油状液体.下层为水溶液.据测定.上层物质为乙醛的加聚物作(C2H4O)n.它的沸点比水的沸点高.分子中无醛基.乙醛在溶液中易被氧化.为从变质的乙醛溶液中提取乙醛.可利用如下反应原理:(C2H4O)n → nC2H4O. (1)先把混合物分离得到(C2H4O)n,将混合物放入分液漏斗.分层清晰后.分离操作是 (2)若将少量乙醛溶液滴入浓硫酸中.生成黑色物质.请用化学方程式表示这一过程: (3)提取乙醛的装置如右图,烧瓶中放的是(C2H4O)n和6 mol·L- H2SO4的混合液.锥形瓶中放蒸馏水.加热至混合液沸腾.(C2H4O)n缓慢分解.生成的气体导入锥形瓶的水中. ①用冷凝管的目的是 . ②锥形瓶内导管口出现的气泡从下上升到液面的过程中.体积越来越小.直至完全消失.这现象说明乙醇的何种物理性质? 当观察到导管中的气流已很少时.必要的操作 ③若n=3.则(C2H4O)n的结构简式是: 高 三 化 学 答 卷 纸 注意:将选择题答案涂到答题卡上! 15.
网址:http://m.1010jiajiao.com/timu3_id_390605[举报]
21A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
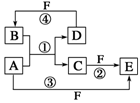
(1) 若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则A元素在周期表中的位置 ,D的原子结构示意图为 ,
反应①的化学方程式为_____________________________________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。
反应②也在水溶液中进行,其离子方程式是________________________,
已知光照条件下D与F反应生成B,写出该反应的化学方程式:_________________。
查看习题详情和答案>>