摘要:26.(1)第二周期VA族:三角锥形: (2)N2(g)+3H2(g) 2NH3(g),△H=-92.4kJ·mol- (3)NO2气体中存在化学平衡2NO2 N2O4.实验测定的是NO2与N2O4混合气体的平均相对分子质量. (4)8NH3+3Cl2=N2+6NH4Cl, =[/11]/1×28==1.13
网址:http://m.1010jiajiao.com/timu3_id_390306[举报]
 (2011?福建模拟)原子序数递增的部分短周期主族元素的原子半径数据如下表:
(2011?福建模拟)原子序数递增的部分短周期主族元素的原子半径数据如下表:| 元素 | A | B | D | E | F | G | M | N | P |
| 原子半径/nm | 0.077 | 0.070 | 0.066 | 0.064 | 0.186 | 0.160 | 0.143 | 0.104 | 0.099 |
(2)B在周期表中的位置为
第二周期VA族
第二周期VA族
;AD2的电子式为

(3)M的最高价氧化物的水化物是胃药“胃舒平”的主要成分,可以治疗胃酸过多,反应的离子方程式为
Al(OH)3+3H+═Al3++3H2O
Al(OH)3+3H+═Al3++3H2O
.(4)AD2与ND2性质相似,G在ND2中也可以剧烈燃烧,可能的产物是
MgO、MgS、S
MgO、MgS、S
,反应的化学方程式为2Mg+SO2
2MgO+S,Mg+S
MgS
| ||
| ||
2Mg+SO2
2MgO+S,Mg+S
MgS
.
| ||
| ||
下表是元素周期表的一部分,据此请回答下列问题.
(1)化学性质最不活泼的是(填名称,下同)
E原子的结构示意图
 F离子的结构示意图
F离子的结构示意图

(2)C最高价氧化物的水化物分别与A、G最高价氧化物的水化物反应的离子方程式
(3)G元素和A元素形成的化合物的电子式是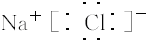
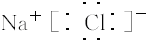 .
.
(4)A、B、C、G四种元素对应离子半径的由大到小顺序是
(5)某元素的原子L层电子数比K层电子数多3个,该元素在元素周期表中位于
查看习题详情和答案>>
| 主族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | H | |||||||
| 2 | D | E | F | |||||
| 3 | A | B | C | G |
氦
氦
,金属性最强的是钠
钠
,非金属性最强的是氟
氟
.E原子的结构示意图




(2)C最高价氧化物的水化物分别与A、G最高价氧化物的水化物反应的离子方程式
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
,Al(OH)3+3H+=Al3++3H2O
Al(OH)3+3H+=Al3++3H2O
.(3)G元素和A元素形成的化合物的电子式是
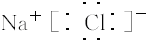
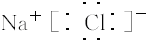
(4)A、B、C、G四种元素对应离子半径的由大到小顺序是
Cl->Na+>Mg2+>Al3+
Cl->Na+>Mg2+>Al3+
(用离子符号表示).(5)某元素的原子L层电子数比K层电子数多3个,该元素在元素周期表中位于
第二周期ⅤA族
第二周期ⅤA族
(周期、族) 元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.(1)阴影部分元素N在元素周期表中的位置为
第二周期第VA族
第二周期第VA族
.根据元素周期律,请你预测:H3AsO4、H3PO4的酸性强弱:H3AsO4
<
<
H3PO4.(用“>”、“<”或“=”表示)(2)元素S的最高正价和最低负价分别为
+6
+6
、-2
-2
,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下,等物质的量的S和Se分别与等量的H2反应,生成气态氢化物的物质的量(b)
(b)
.(a) H2S<H2Se (b) H2S>H2Se (c) H2S=H2Se
(3)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构.用电子式表示羰基硫分子的形成过程:


(4)试在表上画出金属和非金属的分界线


现有下列短周期元素性质的数据:
试回答下列问题:
(1)上述元素中处于第 VA族的有 ,处于第二周期的有 (以上均用编号表示).
(2)上述元素中金属性最强的是 (用编号表示).
(3)写出元素①、⑧形成的化合物与KOH溶液反应的化学方程式 .
(4)经验表明,除氢和氦外,当元素原子的电子层数(n)多于或等于原子最外层电子数(m)即(n-m)≥0时,该元素属于金属元素;当元素原子的最外层电子数(m)多于原子的电子层数(n)即(n-m)<0时,该元素属于非金属元素.试回答:
a.第n(n≥2)周期有 种非金属元素(用含n的代数式表示,含零族元素).
b.根据周期表中每个周期非金属元素的种数,预测周期表中应有 种非金属元素(含零族元素),还有 种未发现,未发现的非金属处在第 周期第 族(注:将零族看作 VIIIA族).
查看习题详情和答案>>
| 元素编号 元素性质 |
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)上述元素中处于第 VA族的有
(2)上述元素中金属性最强的是
(3)写出元素①、⑧形成的化合物与KOH溶液反应的化学方程式
(4)经验表明,除氢和氦外,当元素原子的电子层数(n)多于或等于原子最外层电子数(m)即(n-m)≥0时,该元素属于金属元素;当元素原子的最外层电子数(m)多于原子的电子层数(n)即(n-m)<0时,该元素属于非金属元素.试回答:
a.第n(n≥2)周期有
b.根据周期表中每个周期非金属元素的种数,预测周期表中应有
下图是元素周期表的短周期部分,序号a~h代表8种常见元素.
请用相应的化学用语回答下列问题:
(1)画出g原子结构示意图
 .
.
(2)写出元素h的单质与元素a、c形成的简单化合物发生置换反应的化学方程式
(3)写出f单质与a、d、e三种元素形成的化合物水溶液反应的化学方程式
(4)a、b元素形成的最简单化合物与d单质可组成燃料电池(以KOH溶液作电解质溶液),写出正极的电极反应式:
查看习题详情和答案>>
| IA | O族 | |||||||||
| 第一周期 | a | IIA | IIIA | IVA | VA | VIA | VIIA | |||
| 第二周期 | b | c | d | |||||||
| 第三周期 | e | f | g | h | ||||||
(1)画出g原子结构示意图


(2)写出元素h的单质与元素a、c形成的简单化合物发生置换反应的化学方程式
3Cl2+2NH3=N2+6HCl
3Cl2+2NH3=N2+6HCl
.(3)写出f单质与a、d、e三种元素形成的化合物水溶液反应的化学方程式
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
.(4)a、b元素形成的最简单化合物与d单质可组成燃料电池(以KOH溶液作电解质溶液),写出正极的电极反应式:
O2+2H20+4e-=4OH-
O2+2H20+4e-=4OH-
,负极发生氧化
氧化
反应(填“氧化”或“还原”),OH-移向负
负
极.