摘要:xe- 19.⑴配平下列化学反应方程式(化学计量数为1也请填上.否则视为未配平) ① KClO3+ HCl == KCl+ Cl2↑+ H2O ② KClO3+ HCl == KCl+ Cl2↑+ ClO2↑+ H2O ⑵上述反应①中.电子转移的数目x= , 上述反应②中.还原产物是 . ⑶已知ClO2是黄绿色气体.具有很强的氧化性.常被用作消毒剂.若在相同温度.相同压强下.利用反应①.②分别制得等体积的气体.两者消毒效率之比是 .20.在标准状况下.将V LCl2通入体积为100mL.浓度是1mol/L的FeBr2溶液中.(已知氧化性:Br2>Fe3+) ⑴若V<1L.写出反应的离子方程式 . ⑵若V=2.24L.写出反应的离子方程式 . ⑶若反应后溶液中有的Br-被氧化.V= L.
网址:http://m.1010jiajiao.com/timu3_id_39007[举报]
(2011?常州三模)液态锂离子电池是Li+嵌入化合物的二次电池.正极采用锂化合物LiCoO2,负极采用碳电极,充电后成为锂-碳层间化合物LixC6(0<x≤1),电解质为溶解有锂盐LiPF6、LiAsF6等的有机溶液.下列有关说法错误的是( )
查看习题详情和答案>>
从淡化海水中提取溴的流程如下:LiCoO2-xe-═Li(1-x)CoO2+xLi+
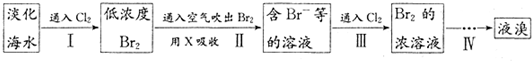
下列有关说法不正确的是( )

下列有关说法不正确的是( )
| A、X试剂可用Na2SO3饱和溶液 | B、步骤ID的离子反应:2Br-+Cl2═2Cl-+Br2 | C、工业上每获得1mol Br2,需要消耗Cl2 44.8L | D、步骤IV包含萃取、分液和蒸馏 |
液态锂离子电池是Li+嵌入化合物的二次电池.正极采用锂化合物LiCoO2,负极采用碳电极,充电后成为锂-碳层间化合物LixC6(0<x≤1),电解质为溶解有锂盐LiPF6、LiAsF6等的有机溶液.下列有关说法错误的是( )
查看习题详情和答案>>
| A.LiCoO2改写为氧化物的形式为:Li2O?Co2O3 |
| B.该电池的电解液使用有机溶剂主要是由于有机溶剂与锂盐有很好的互溶性 |
| C.该电池充电时的反应为:Li++6C+xe-=LixC6+(1-x)Li+ |
| D.放电时电解质中PF6-和AsF6-等离子向负极移动 |
(1)在核反应中虽没有电子参与,但核反应方程式仍然遵守质量数守恒和核电荷数守恒.已知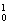 n表示中子,在下列四个方程中,x1、x2、x3和x4各代表某种粒子( )
n表示中子,在下列四个方程中,x1、x2、x3和x4各代表某种粒子( )
①![]() U+
U+![]() n
n![]()
![]() Sr+
Sr+![]() Xe+3x1
Xe+3x1
②![]() H+x2
H+x2![]()
![]() He+
He+![]() n
n
③![]() U
U![]()
![]() Th+x3
Th+x3
④![]() Mg+
Mg+![]() He
He![]()
![]() Al+x4
Al+x4
以下判断中正确的是( )
A.x1是中子 B.x2是质子
C.x3是α粒子 D.x4是![]() H
H
(2)在美国肯尼迪高能物理研究所,科学家由![]() Zn撞入一个
Zn撞入一个![]() Pb的原子核中,立即释放出一个中子(
Pb的原子核中,立即释放出一个中子(![]() n)而产生了一种新元素,这种元素在自然界停留不超过30 s.这种新元素的原子组成表达式为__________(元素符号用X表示).
n)而产生了一种新元素,这种元素在自然界停留不超过30 s.这种新元素的原子组成表达式为__________(元素符号用X表示).
查看习题详情和答案>>
实验室要用98%(密度为1.84g?cm-3)的硫酸配制3.68mol/L的硫酸500mL.实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解
④转移、洗涤 ⑤定容、摇匀
回答下列问题
(1)需准确量取98%的硫酸
(从下列中选用 A.10ml B.20ml C.50ml D.100ml)
(2)要配制3.68mol/L的硫酸500mL,必须用到的仪器是(填写序号)
①500mL量筒 ②烧杯 ③1 000mL容量瓶 ④500mL容量瓶 ⑤天平 ⑥胶头滴管 ⑦锥形瓶 ⑧玻璃棒
(3)若配制3.68mol/L的硫酸,其他操作均正确,下列操作会使所配硫酸溶液浓度偏低的是
A.将稀释的硫酸转移至容量瓶后,未洗涤烧杯和玻璃棒
B.将烧杯内的稀硫酸向容量瓶内转移时,因操作不当使部分稀硫酸溅出瓶外
C.用胶头滴管向容量瓶中加水时凹液面高于容量瓶刻度线,此时立即用胶头滴管将瓶内多余液体吸出,使溶液凹液面与刻度线相切
D.用胶头滴管向容量瓶中加入水时,仰视观察溶液凹液面与容量瓶刻度线相切
E.所用的浓硫酸长时间放置在密封不好的容器中
(4)若配制时,因加水不慎超过了容量瓶刻度线,此时实验应如何继续进行?
查看习题详情和答案>>
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解
④转移、洗涤 ⑤定容、摇匀
回答下列问题
(1)需准确量取98%的硫酸
100
100
mL.量取浓硫酸所用的量筒的规格是D
D
(从下列中选用 A.10ml B.20ml C.50ml D.100ml)
(2)要配制3.68mol/L的硫酸500mL,必须用到的仪器是(填写序号)
②④⑥⑧
②④⑥⑧
.①500mL量筒 ②烧杯 ③1 000mL容量瓶 ④500mL容量瓶 ⑤天平 ⑥胶头滴管 ⑦锥形瓶 ⑧玻璃棒
(3)若配制3.68mol/L的硫酸,其他操作均正确,下列操作会使所配硫酸溶液浓度偏低的是
ABCDE
ABCDE
(选填序号).A.将稀释的硫酸转移至容量瓶后,未洗涤烧杯和玻璃棒
B.将烧杯内的稀硫酸向容量瓶内转移时,因操作不当使部分稀硫酸溅出瓶外
C.用胶头滴管向容量瓶中加水时凹液面高于容量瓶刻度线,此时立即用胶头滴管将瓶内多余液体吸出,使溶液凹液面与刻度线相切
D.用胶头滴管向容量瓶中加入水时,仰视观察溶液凹液面与容量瓶刻度线相切
E.所用的浓硫酸长时间放置在密封不好的容器中
(4)若配制时,因加水不慎超过了容量瓶刻度线,此时实验应如何继续进行?
重新配置
重新配置
.