网址:http://m.1010jiajiao.com/timu3_id_389603[举报]
(1)A、B、C、D四种元素的名称分别是
(2)C-的结构示意图为


(3)元素D的气态氢化物的电子式为


(4)工业上冶炼单质A的化学方程式为
| ||
| ||
(5)工业上常用单质B冶炼难熔的金属,写出氧化铁和单质B在高温下反应的化学方程式
| ||
| ||
(6)若将单质A、B用导线连接插入到氢氧化钠溶液中可以组成原电池,则正极材料是
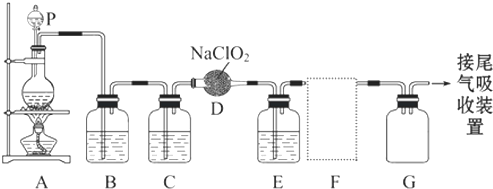
如图是实验室用于制备和收集一定量纯净的ClO2的装置(某些夹持装置和垫持用品省略).其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2).
(1)仪器P的名称是
(2)写出装置A中烧瓶内发生反应的化学方程式:
| ||
| ||
(3)B装置中所盛试剂是
(4)F处应选用的收集装置是
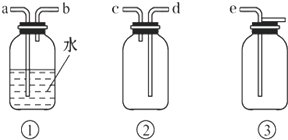
(5)以下是尾气吸收装置,能用于吸收多余ClO2气体,并能防止倒吸的装置的是
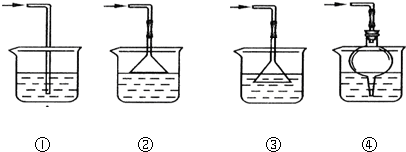
A.①②B.②③C.③④D.②④
(6)若用100mL 2mol?L-1的浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量是
A.>0.1mol B.0.1mol
C.<0.1mol D.无法判断.
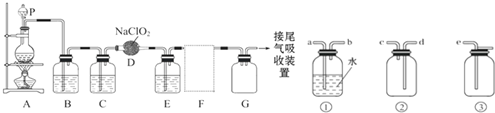
用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2).
(1)仪器P的名称是
(2)写出装置A中烧瓶内发生反应的离子方程式:
| ||
| ||
(3)B装置中所盛试剂是
(4)F处应选用的收集装置是
(5)G装置的作用是
(6)若用100mL 2mol?L-1的浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量是
A.>0.1mol B.0.1mol C.<0.1mol D.无法判断.
(共6分)
有一硝酸盐晶体,其化学式为M(NO3)x·yH2O,相对分子质量为242。取1.21g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.01mol电子发生转移时,溶液中金属全部析出。经称量阴极增重0.32g。求:
(1)(4分)金属M的相对原子质量及x、y值。
(2)(2分)电解后溶液的pH(电解过程中溶液体积变化忽略不计)
查看习题详情和答案>>
(12 分)(每空2分)CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol·L-1的CH3COOH溶液与50mL 0.2mol·L-1的NaOH溶液混合,所得溶液呈 性,原因 (用离子方程式表示)。
(3)已知某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)> c(H+)> c(Na+)> c(OH-),则该溶液中含有的溶质为 。
(4)已知Ka(CH3COOH)= 1.76×10-5,Ka(HNO2)= 4.6×10-4,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:
前者 后者(填“>,<或=”)
(5)已知25℃时,0.1mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠呈碱性,所以溶液的pH增大;乙同学给出另外一种不同于甲同学的解释,请你写出乙同学可能的理由