网址:http://m.1010jiajiao.com/timu3_id_389009[举报]
(13分)二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一。
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中 能导致光化学烟雾的形成;
目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化。如:CO(g)+NO2(g) NO(g)+CO2(g) △H=-akJ·mol—1(a>0)2CO(g)+2NO2(g) N2(g)+2CO2(g) △H=-bkJ·mol—1(b>0)
据此回答:若用标准状况下3.36升CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为 mol,放出的热量为 kJ(用含有a和b的代数式表示)。
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (只要求写一种)。
(3)工业上生产硫酸时,将SO2氧化为SO3是关键一步。
①某温度下,SO2(g)+1/2O2(g)![]() SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K= 。
SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K= 。
②一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后改变下述条件SO3 的体积分数变大的是
2SO3(g)达到平衡后改变下述条件SO3 的体积分数变大的是
A.保持温度和容器压强不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
E.升高温度 F.移动活塞压缩气体
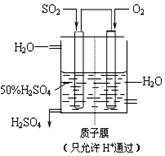
(4)某人设想以右上图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:
。
查看习题详情和答案>>
(13分)二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一。
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中 能导致光化学烟雾的形成;
目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化。如:CO(g)+NO2(g) NO(g)+CO2(g)
△H=-akJ·mol—1(a>0)2CO(g)+2NO2(g) N2(g)+2CO2(g)
△H=-bkJ·mol—1(b>0)
据此回答:若用标准状况下3.36升CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为 mol,放出的热量为 kJ(用含有a和b的代数式表示)。
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (只要求写一种)。
(3)工业上生产硫酸时,将SO2氧化为SO3是关键一步。
①某温度下,SO2(g)+1/2O2(g) SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=
。
SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=
。
②一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g) 2SO3(g)达到平衡后改变下述条件SO3 的体积分数变大的是
2SO3(g)达到平衡后改变下述条件SO3 的体积分数变大的是
A.保持温度和容器压强不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
E.升高温度 F.移动活塞压缩气体
(4)某人设想以右上图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:
。
查看习题详情和答案>>
(13分)二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一。
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中 能导致光化学烟雾的形成;
目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化。如:CO(g)+NO2(g) NO(g)+CO2(g) △H=-akJ·mol—1(a>0)2CO(g)+2NO2(g) N2(g)+2CO2(g) △H=-bkJ·mol—1(b>0)
据此回答:若用标准状况下3.36升CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为 mol,放出的热量为 kJ(用含有a和b的代数式表示)。
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (只要求写一种)。
(3)工业上生产硫酸时,将SO2氧化为SO3是关键一步。
①某温度下,SO2(g)+1/2O2(g)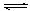 SO3(g);△H=" —98" kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K= 。
SO3(g);△H=" —98" kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K= 。
②一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)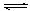 2SO3(g)达到平衡后改变下述条件SO3 的体积分数变大的是
2SO3(g)达到平衡后改变下述条件SO3 的体积分数变大的是
A.保持温度和容器压强不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
E.升高温度 F.移动活塞压缩气体
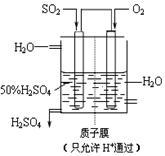
(4)某人设想以右上图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:
。
实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸,反应式如下:

已知:①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃)
②乙醚沸点34.6℃,密度0.7138,易燃烧,当空气中含量为1.83%~48.0%时易发生爆炸


图1 制备苯甲酸和苯甲醇的反应装置图 图2 蒸乙醚的装置图
实验步骤如下:
①向图1所示装置中加入8g氢氧化钠和30mL水,搅拌溶解。稍冷,加入10 mL新蒸过的苯甲醛。开启搅拌器,调整转速,使搅拌平稳进行。加热回流约40 min。
②停止加热,从球形冷凝管上口缓缓加入冷水20mL,摇动均匀,冷却至室温。反应物冷却至室温后,倒入分液漏斗,用乙醚萃取三次,每次10mL。水层保留待用。合并三次萃取液,依次用5 mL饱和亚硫酸氢钠溶液洗涤,10mL 10%碳酸钠溶液洗涤,10 mL水洗涤。
③分出醚层,倒入干燥的锥形瓶,加无水硫酸镁,注意锥形瓶上要加塞。将锥形瓶中溶液转入图2所示蒸馏装置,缓缓加热。升高温度蒸馏,当温度升到140℃时改用空气冷凝管,收集198℃~204℃的馏分得产品A。将萃取后的水溶液慢慢地加入到盛有30 mL浓盐酸和30 mL水的混合物中,同时用玻璃棒搅拌,析出白色固体。冷却,抽滤,得到粗产品,然后提纯得产品B。
根据以上步骤回答下列问题:
(1)步骤①中所加的苯甲醛为什么要是新蒸的?_____________________________________。
(2)步骤②萃取时用到的玻璃仪器除了除烧杯、玻璃棒外,还需______________________,饱和亚硫酸氢钠溶液洗涤是为了除去__________________,而碳酸钠溶液洗涤是为了除去醚层中极少量的苯甲酸。
(3)步骤③中无水硫酸镁的作用是_________________,将锥形瓶中溶液转入图2所示蒸馏装置时涉及的实验操作为__________________。
(4)产品A为____________,蒸馏除乙醚的过程中采用的加热方式为_______________,提纯产品B所用到的实验操作为________________。
查看习题详情和答案>>
实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸,反应式如下:

已知:①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃)
②乙醚沸点34.6℃,密度0.7138,易燃烧,当空气中含量为1.83%~48.0%时易发生爆炸


图1 制备苯甲酸和苯甲醇的反应装置图 图2 蒸乙醚的装置图
实验步骤如下:
①向图1所示装置中加入8g氢氧化钠和30mL水,搅拌溶解。稍冷,加入10 mL新蒸过的苯甲醛。开启搅拌器,调整转速,使搅拌平稳进行。加热回流约40 min。
②停止加热,从球形冷凝管上口缓缓加入冷水20mL,摇动均匀,冷却至室温。反应物冷却至室温后,倒入分液漏斗,用乙醚萃取三次,每次10mL。水层保留待用。合并三次萃取液,依次用5 mL饱和亚硫酸氢钠溶液洗涤,10mL 10%碳酸钠溶液洗涤,10 mL水洗涤。
③分出醚层,倒入干燥的锥形瓶,加无水硫酸镁,注意锥形瓶上要加塞。将锥形瓶中溶液转入图2所示蒸馏装置,缓缓加热。升高温度蒸馏,当温度升到140℃时改用空气冷凝管,收集198℃~204℃的馏分得产品A。将萃取后的水溶液慢慢地加入到盛有30 mL浓盐酸和30 mL水的混合物中,同时用玻璃棒搅拌,析出白色固体。冷却,抽滤,得到粗产品,然后提纯得产品B。
根据以上步骤回答下列问题:
(1)步骤①中所加的苯甲醛为什么要是新蒸的?________________________________。
(2)步骤②萃取时用到的玻璃仪器除了除烧杯、玻璃棒外,还需______________________,饱和亚硫酸氢钠溶液洗涤是为了除去__________________,而碳酸钠溶液洗涤是为了除去醚层中极少量的苯甲酸。
(3)步骤③中无水硫酸镁的作用是_________________,将锥形瓶中溶液转入图2所示蒸馏装置时涉及的实验操作为__________________。
(4)产品A为____________,蒸馏除乙醚的过程中采用的加热方式为_______________,提纯产品B所用到的实验操作为________________。
查看习题详情和答案>>