摘要:28某化学兴趣小组的同学买来一瓶“84 消毒液.请大家与他们一同来研讨以下问题: (1)此瓶“84 消毒液的说明书上这样写道:“本品为无色液体.呈碱性-- . ①请推测它的有效成分 A.Cl2 B.H2O2 C.NaClO D.KMnO4 ②请用离子方程式表示此“84 消毒液呈碱性的原因是 . (2)该化学兴趣小组的同学分别在瓷碗和铁锅中盛放20 mL的“84 消毒液.露置在阳光充足的室内. 他们首先对瓷碗中盛放的消毒液的消毒效果和组成成分的变化进行了研究.所得数据图如下 对比数据图1和2得到的结论有:消毒液暴露在空气中.随着时间的推移.它的消毒效果 .溶液的碱性 , (3)该化学实验小组同学上网查询有关“84 消毒液的信息时.发现这样一则消息:有一家庭主妇把抗SARS用的 84“消毒液和清洁剂(呈酸性.含Cl-)都倒出一些混合在一起.进行刷洗.一会儿.她就晕倒在房间里.这几位同学感到迷惑不解.请你用离子方程式帮助他们解开这一悬念: . (4) 实验小组同学通过本次探究性学习.感到收获颇多.同时了解到商品说明书 的重要性.请你根据以上事实将下列“84 消毒液的说明书补充完整 有效成分 主要用途 1.可对餐具.瓜果.衣物及环境进行消毒 2.可漂白浅色衣物 注意事项 1.对带色衣物和丝毛织品易脱色.变黄 2.原液如接触皮肤.用清水冲洗即可 3.原液对金属易腐蚀 4. 5. 贮藏 保质期 有效期10个月.一段时间后.药量应增加使用 2921世纪是全世界大规模开发利用海洋资源.发展海洋经济的新时期.为了人类和平利用海洋资源.今年我国环球科学考察船“大洋一号 首次执行环球大洋科学考察任务.海水占地球总储水量的97.2%.若把海水淡化和化工生产结合起来.既可解决淡水资源缺乏的问题.又可充分利用海洋资源. (1)海水中存在大量的氯化钠.氯化钠中的金属元素位于元素周期表第 族. (2)目前国际上实用的“海水淡化 主要技术之一是蒸馏法.蒸馏法是将海水变成蒸汽.蒸汽经冷却而得高纯度淡水.由此可判断蒸馏法是 (填:物理变化或化学变化). (3)工业上利用电解饱和食盐水可制得重要化工产品.该反应的化学方程式为: (4)近年来.有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫的废气并回收二氧化硫的方法.该方法流程如下: 写出 ②反应的离子方程式: , ④反应的化学方程式 . (5)上述亚硫酸氢钠与甲醛经过一定反应可以合成俗称“吊白块 的物质.因该物质对人体有害.不能用于食品漂白.“吊白块 结构简式为:HOCH2SO3Na.根据其结构特点.“吊白块 能发生的反应有 . A.皂化反应 B. 与金属钠反应 C. 氧化反应 D. 加成反应 08届高三第三次月考化学试题答案及评分标准 选择题答题卡(共70分) 21. ①④⑤ (每对一个得2分.错一个倒扣2分)
网址:http://m.1010jiajiao.com/timu3_id_387881[举报]
氨在国民经济中占有重要的地位,2008年,我国氨产量接近500万吨.下图是合成氨的简要流程.

(1)下表是空气中部分气体的沸点.将空气液化加热分馏,依据下表数据判断,最先气化得到的气体是
(2)天然气、重油、煤都可以与水反应制得氢气.下表是某合成氨厂采用不同原料的相对投资和能量消耗.
①依据上表信息,你认为采用
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ?mol-1;
2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-484kJ?mol-1;
试写出由C于水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式
(3)下表是在某种催化剂作用下用体积比为1:3的氮、氢混合气反应应达到平衡时的一些实验数据.
①依据表中数据判断,合成氨反应N2+3H2 2NH3的△H
2NH3的△H
②该反应的化学平衡常数表达式为
.
③在300℃、10MPa下,合成氨反应达到平衡时,混合气体的体积是反应开始时的
查看习题详情和答案>>

(1)下表是空气中部分气体的沸点.将空气液化加热分馏,依据下表数据判断,最先气化得到的气体是
氦气
氦气
.| 气体名称 | 氨气 | 氧气 | 氦气 | 氖气 | 氩气 | 氪气 | 氚气 |
| 沸点/℃ | -196 | -183 | -269 | -264 | -186 | -153 | -108 |
| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J?t-1 | 28×109 | 38×109 | 48×109 |
天然气
天然气
为原料最好.②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:
CH4+H2O
CO+3H2
| ||
| 高温 |
CH4+H2O
CO+3H2
.
| ||
| 高温 |
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ?mol-1;
2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-484kJ?mol-1;
试写出由C于水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式
C(s)+H2O(g)=CO(g)+H2(g)△H=+131kJ?mol-1
C(s)+H2O(g)=CO(g)+H2(g)△H=+131kJ?mol-1
.(3)下表是在某种催化剂作用下用体积比为1:3的氮、氢混合气反应应达到平衡时的一些实验数据.
| NH3含量% 压强/MPa 温度/℃ |
0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
 2NH3的△H
2NH3的△H<
<
(填“>”、“<”或“无法判断”)0,请简要说明理由相同条件下,升高温度,NH3含量减小,平衡左移,逆反应吸热,正反应放热
相同条件下,升高温度,NH3含量减小,平衡左移,逆反应吸热,正反应放热
;②该反应的化学平衡常数表达式为
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
③在300℃、10MPa下,合成氨反应达到平衡时,混合气体的体积是反应开始时的
0.66
0.66
倍.氨在国民经济中占有重要的地位,2008年,我国氨产量接近500万吨.下图是合成氨的简要流程.

(1)下表是空气中部分气体的沸点.将空气液化加热分馏,依据下表数据判断,最先气化得到的气体是______.
(2)天然气、重油、煤都可以与水反应制得氢气.下表是某合成氨厂采用不同原料的相对投资和能量消耗.
①依据上表信息,你认为采用______为原料最好.
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:______.
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ-mol-1;
2CO(g)+O2(g)═2CO2(g)△H=-566kJ-mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-484kJ-mol-1;
试写出由C于水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式______.
(3)下表是在某种催化剂作用下用体积比为1:3的氮、氢混合气反应应达到平衡时的一些实验数据.
①依据表中数据判断,合成氨反应N2+3H2
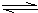
2NH3的△H______(填“>”、“<”或“无法判断”)0,请简要说明理由______;
②该反应的化学平衡常数表达式为______.
③在300℃、10MPa下,合成氨反应达到平衡时,混合气体的体积是反应开始时的______倍.
查看习题详情和答案>>

(1)下表是空气中部分气体的沸点.将空气液化加热分馏,依据下表数据判断,最先气化得到的气体是______.
| 气体名称 | 氨气 | 氧气 | 氦气 | 氖气 | 氩气 | 氪气 | 氚气 |
| 沸点/℃ | -196 | -183 | -269 | -264 | -186 | -153 | -108 |
| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J-t-1 | 28×109 | 38×109 | 48×109 |
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:______.
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ-mol-1;
2CO(g)+O2(g)═2CO2(g)△H=-566kJ-mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-484kJ-mol-1;
试写出由C于水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式______.
(3)下表是在某种催化剂作用下用体积比为1:3的氮、氢混合气反应应达到平衡时的一些实验数据.
| NH3含量% 压强/MPa 温度/℃ |
0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
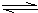
2NH3的△H______(填“>”、“<”或“无法判断”)0,请简要说明理由______;
②该反应的化学平衡常数表达式为______.
③在300℃、10MPa下,合成氨反应达到平衡时,混合气体的体积是反应开始时的______倍.
(2001,上海,28)某有机物A(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内为多。该化合物具有如下性质:
①在25℃时,电离常数k1=3.99´10-4,k2=5.5´10-6
②A+RCOOH(或ROH)![]() 有香味的产物
有香味的产物
③1molA![]() 慢慢产生1.5mol气体
慢慢产生1.5mol气体
④A在一定温度下的脱水产物(不是环状化合物)可和溴水发生加成反应:
试回答:
(1)根据以上信息,对A的结构可作出的判断是________
(多选扣分)
(a)肯定有碳碳双键
(b)有两个羧基
(c)肯定有羟基
(d)有—COOR官能团
(2)有机物A的结构简式(不含—CH3)为________。
(3)A在一定温度下的脱水产物和溴水反应的化学方程式:________。
(4)A的一个同类别的同分异构体是________。
查看习题详情和答案>>
(2001,上海,28)某有机物A(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内为多。该化合物具有如下性质:
①在25℃时,电离常数k1=3.99´10-4,k2=5.5´10-6
②A+RCOOH(或ROH)![]() 有香味的产物
有香味的产物
③1molA![]() 慢慢产生1.5mol气体
慢慢产生1.5mol气体
④A在一定温度下的脱水产物(不是环状化合物)可和溴水发生加成反应:
试回答:
(1)根据以上信息,对A的结构可作出的判断是________
(多选扣分)
(a)肯定有碳碳双键
(b)有两个羧基
(c)肯定有羟基
(d)有—COOR官能团
(2)有机物A的结构简式(不含—CH3)为________。
(3)A在一定温度下的脱水产物和溴水反应的化学方程式:________。
(4)A的一个同类别的同分异构体是________。
查看习题详情和答案>>