摘要:晶体硅是一种重要的非金属材料.制备纯硅的主要步骤如下: ①高温下用过量的碳还原二氧化硅制得粗硅, ②粗硅与干燥的HCl气体反应制得SiHCl3 (Si+3HCl→SiHCl3+H2) ③SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅.已知SiHCl3能与水强烈反应.在空气中易自燃. 请回答: (1)第一步制取粗硅的化学方程式 (2)粗硅与HCl反应完全后.经冷凝得到的SiHCl3中含有少量SiCl4和HCl.提纯SiHCl3可采用 的方法. (3)实验室用SiHCl3与过量的H2反应制取纯硅的装置如图所示: ① 装置B中的试剂是 .装置C需水浴加热.目的是 . ② 反应一段时间后.装置D中可观察到有晶体硅生成.装置D不能采用普通玻璃管的原因是 .D中发生的反应的化学方程式是 . ③ 为保证实验的成功.操作的关键除题中已告知的之外.你认为最重 要的还有: .
网址:http://m.1010jiajiao.com/timu3_id_387105[举报]
晶体硅是一种重要的非金属材料,在现代电子工业中具有非常重要的应用.工业上制备高纯硅的主要步骤如下:

(1)下列有关硅及化合物的说法,正确的是
A.石英的主要成分是SiO2
B.太阳能电池使用单质硅做材料,其应用有利于环保、节能
C.粗硅制备高纯硅的过程不涉及氧化还原反应
D.玻璃、水泥、陶瓷都属于硅酸盐产品
(2)SiCl4在室温下为无色液体,易挥发,粗硅与氯气反应得到的粗SiCl4中含有大量固体杂质,通过“操作A”提纯得到纯SiCl4,操作A的名称是
(3)整个制备过程必须严格控制无水无氧.H2还原SiCl4过程中发生的反应是:
查看习题详情和答案>>

(1)下列有关硅及化合物的说法,正确的是
ABD
ABD
.A.石英的主要成分是SiO2
B.太阳能电池使用单质硅做材料,其应用有利于环保、节能
C.粗硅制备高纯硅的过程不涉及氧化还原反应
D.玻璃、水泥、陶瓷都属于硅酸盐产品
(2)SiCl4在室温下为无色液体,易挥发,粗硅与氯气反应得到的粗SiCl4中含有大量固体杂质,通过“操作A”提纯得到纯SiCl4,操作A的名称是
蒸馏(分馏、精馏均可)
蒸馏(分馏、精馏均可)
.(3)整个制备过程必须严格控制无水无氧.H2还原SiCl4过程中发生的反应是:
2H2+SiCl4
Si+4HCl
| ||
2H2+SiCl4
Si+4HCl
在该过程中若有O2混入,可能引起的后果是
| ||
引起爆炸
引起爆炸
.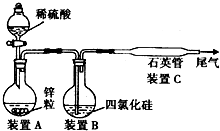 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:①高温下用碳还原二氧化硅制得粗硅:SiO2+2C
| ||
②粗硅与干燥的Cl2反应制得SiCl4:Si+2C12
| ||
③SiCl4被过量的H2在1 000~1 100℃时还原制得纯硅:SiCl4+2H2
| ||
某同学从资料中查知:SiCl4的熔点为-7O℃,沸点为57.6℃,且在潮湿的空气中能发生水解反应.该同学设计了如下制取纯硅的实验装置(热源及夹持装置已略去).请回答下列问题:
(1)使SiCl4从装置B中逸出与H2充分混合,应采取的措施是
对装置B水浴加热
对装置B水浴加热
.(2)装置C不能采用普通玻璃管的原因是
在1000-1100℃时普通玻璃管会软化
在1000-1100℃时普通玻璃管会软化
,石英的化学式是SiO2
SiO2
.(3)如果从装置A中快速向装置B中通入气体,可能观察到的现象是
B中液面上方产生少量白雾,液体中有少量白色胶状物生成
B中液面上方产生少量白雾,液体中有少量白色胶状物生成
.(4)为防止空气污染,含有SiCl4的尾气要通入盛有
NaOH
NaOH
溶液的烧杯中,反应的化学方程式为SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O
SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O
.(5)为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度,还应对该装置进行的改进是
在装置A与B之间连接一盛有浓硫酸的洗气瓶(或盛有碱石灰的干燥管).
在装置A与B之间连接一盛有浓硫酸的洗气瓶(或盛有碱石灰的干燥管).
.晶体硅是一种重要的非金属材料,制备高纯硅的主要流程如图所示:

已知SiHCl3能与H2O强烈反应,生成一种可燃烧的单质气体和两种酸.请回答下列问题:
(1)写出制备粗硅的化学方程式
(2)在生成SiHCl3的反应中,还原剂与还原产物的质量比为
(3)整个制备过程必须控制无水无氧,若有水可能发生的反应是
(4)下列关于硅及其化合物的叙述错误的是
A.二氧化硅晶体中硅氧原子间以共价键结合
B.用于现代通讯的光导纤维的主要成分是高纯度的硅
C.硅与碳位于同一主族,性质相似,在自然界中广泛存在着游离态的硅
D.SiO2和CO2都是酸性氧化物,均可与强碱(如NaOH)溶液反应,而不与任何酸反应.
查看习题详情和答案>>

已知SiHCl3能与H2O强烈反应,生成一种可燃烧的单质气体和两种酸.请回答下列问题:
(1)写出制备粗硅的化学方程式
SiO2+2C
Si+2CO
| ||
SiO2+2C
Si+2CO
.
| ||
(2)在生成SiHCl3的反应中,还原剂与还原产物的质量比为
14:1
14:1
.(3)整个制备过程必须控制无水无氧,若有水可能发生的反应是
3SiHCl3+3H2O=H2SiO3+H2↑+3HCl、C+H2O
CO+H2
| ||
3SiHCl3+3H2O=H2SiO3+H2↑+3HCl、C+H2O
CO+H2
.
| ||
(4)下列关于硅及其化合物的叙述错误的是
B C D
B C D
(填字母代号)A.二氧化硅晶体中硅氧原子间以共价键结合
B.用于现代通讯的光导纤维的主要成分是高纯度的硅
C.硅与碳位于同一主族,性质相似,在自然界中广泛存在着游离态的硅
D.SiO2和CO2都是酸性氧化物,均可与强碱(如NaOH)溶液反应,而不与任何酸反应.
晶体硅是一种重要的非金属材料,SiHCl3与过量H2在1000~1100℃反应制得纯硅,已知液态SiHCl3能与H2O强烈反应,在空气中易自燃.
请回答下列问题:
用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):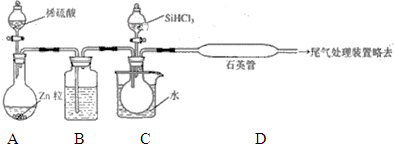
①装置B中的试剂是 .装置C中的烧瓶需要加热,其目的是 .
②反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 ,装置D中发生反应的化学方程式为 .
③为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是 .
a.碘水 b.NaNO3溶液 c.NaOH溶液 d.KSCN溶液.
查看习题详情和答案>>
请回答下列问题:
用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):

①装置B中的试剂是
②反应一段时间后,装置D中观察到的现象是
③为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是
a.碘水 b.NaNO3溶液 c.NaOH溶液 d.KSCN溶液.
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
![]()
③SiHCl3与过量H2在1 000—1
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请完成下列问题:
(1)第①步制备粗硅的化学反应方程式为______________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
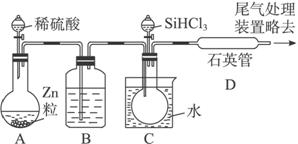
①装置B中的试剂是_______________________。装置C中的烧瓶需要加热,其目的是___________________________________。
②反应一段时间后,装置D中观察到的现象是__________________________,装置D不能采用普通玻璃管的原因是___________________________________,装置D中发生反应的化学方程式为_______________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及________________________________。
查看习题详情和答案>>