网址:http://m.1010jiajiao.com/timu3_id_386925[举报]
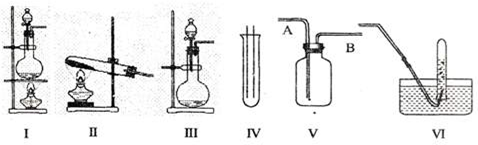
下图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;IV、V、VI是气体收集装置,根据要求回答下列问题:
(1)若用MnO2与浓盐酸反应制取氯气,应选用装置 ,用方程式表示的制取氯气的反应原理是 。
(2)若用KMnO4与浓盐酸反应制取氯气,应选用的装置 ,试完成并配平下列离子方程式:
MnO4-+ C1-+ H+― Mn2++
C12↑+ 。
(3)若选用IV为氯气的收集装置,应该在试管口放置一团棉花,该棉花团应用 溶液浸湿,其作用是 。
(4)若选用V为氯气收集装置,则氯气应从 口通入。用化学方法检验氯气收集满了的方法是 。
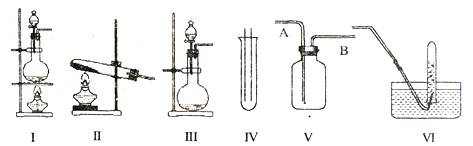
查看习题详情和答案>>(14分)下图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;IV、V、VI是气体收集装置,根据要求回求答下列问题:
(1)气体发生装置的选择:若用CaCO3与盐酸反应制CO2,则可选择 ;(填序号)
若用NH4Cl和Ca(OH)2反应制NH3,则可选择 ;(填序号)
若用MnO2与浓盐酸反应制取氯气,应选用装置 ,(填序号)
用离子方程式表示制取氯气的反应原理是 。
(2)收集装置的选择:若选用V为氯气收集装置,则氯气应从 口通入。用化学方法检验氯气收集满的方法是 。
(3)气体的吸收:若经试验发现,现1体积的水已吸收336体积的HCl,且得到的溶液的密度为1.08g/cm3,则所得溶液中溶质的物质的量浓度为 mol/L。
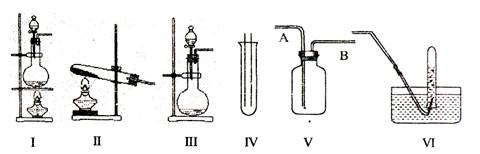
查看习题详情和答案>>(14分)下图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;IV、V、VI是气体收集装置,根据要求回求答下列问题:

(1)气体发生装置的选择:若用CaCO3与盐酸反应制CO2,则可选择 ;(填序号)
若用NH4Cl和Ca(OH)2反应制NH3,则可选择 ;(填序号)
若用MnO2与浓盐酸反应制取氯气,应选用装置 ,(填序号)
用离子方程式表示制取氯气的反应原理是 。
(2)收集装置的选择:若选用V为氯气收集装置,则氯气应从 口通入。用化学方法检验氯气收集满的方法是 。
(3)气体的吸收:若经试验发现,现1体积的水已吸收336体积的HCl,且得到的溶液的密度为1.08g/cm3,则所得溶液中溶质的物质的量浓度为 mol/L。
查看习题详情和答案>>(14分)下图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;IV、V、VI是气体收集装置,根据要求回求答下列问题:

(1)气体发生装置的选择:若用CaCO3与盐酸反应制CO2,则可选择 ;(填序号)
若用NH4Cl和Ca(OH)2反应制NH3,则可选择 ;(填序号)
若用MnO2与浓盐酸反应制取氯气,应选用装置 ,(填序号)
用离子方程式表示制取氯气的反应原理是 。
(2)收集装置的选择:若选用V为氯气收集装置,则氯气应从 口通入。用化学方法检验氯气收集满的方法是 。
(3)气体的吸收:若经试验发现,现1体积的水已吸收336体积的HCl,且得到的溶液的密度为1.08g/cm3,则所得溶液中溶质的物质的量浓度为 mol/L。
查看习题详情和答案>>