网址:http://m.1010jiajiao.com/timu3_id_386536[举报]
(14分)在200℃时,将a
mol H2(g)和b
mol I2(g)充入到体积为V
L的密闭容器中,发生反应:I2(g)+H2(g)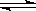 2HI(g)。
2HI(g)。
(1)反应刚开始时,由于c(H2)=_______,c(I2)=_______,而c(HI)=________,所以化学反应速率________最大而________最小(为零)(填“v正”或“v逆”)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)________,c(I2)________,而c(HI)________,从而化学反应速率v正________,而v逆________(填“增大”、“减小”或“不变”) (3)当反应进行到v正与v逆________时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将________。
查看习题详情和答案>>
(14分)已知CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数随温度变化如下表:
CO(g)+H2O(g)的平衡常数随温度变化如下表:
|
t/℃ |
700 |
800 |
850 |
1 000 |
1 200 |
|
K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
请回答下列问题:
(1)上述正向反应是________反应(选填“放热”或“吸热”)。
(2)若达平衡后降温,则平衡向________移动,CO2转化率________,正反应速率________(选填“增大”、“减小”或“不变”)。
(3)在850℃发生上述反应,以表中的物质的量投入恒容反应器中,其中向正反应方向移动的有________(选填A、B、C、D、E)
|
|
A |
B |
C |
D |
E |
|
n(CO2) |
3 |
1 |
0 |
1 |
1 |
|
n(H2) |
2 |
1 |
0 |
1 |
2 |
|
n(CO) |
1 |
2 |
3 |
0.5 |
3 |
|
n(H2O) |
5 |
2 |
3 |
2 |
1 |
(4)在850℃时,可逆反应:CO2(g)+H2(g) CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
|
时间/min |
CO2 (mol/L) |
H2 (mol/L) |
CO (mol/L) |
H2O (mol/L) |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
c3 |
则3 min~4 min平衡后c3=______________,CO2的转化率为____________。
查看习题详情和答案>>
(14分)下面是18×7的格子,按要求作答。
| A | | | | | | | | | | | | | | | | | He |
| | | | | | | | | | | | | | | C | D | | |
| | E | | | | | | | | | | | F | | | | H | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
(2)“大爆炸理论”指出:200亿年以前,宇宙中所有物质都包含在一个密度无限大,温度无限高的原始核中,由于某种原因它发生了爆炸,首先产生了中子、质子和电子,随后就产生了元素。你由此可知最先产生的元素是_______(填写元素名称)(1分),其中子数比质子数多1的核素的原子符号是_________;(1分)
(3)C、D、E、F的简单离子半径由小到大顺序是_______________________(填写离子符号);(2分)
(4)请用电子式表示出E和H形成的化合物形成过程:_____________________________;(2分)
(5)用实线绘出金属与非金属的分界线。注意:不得使用铅笔作图。(2分)
(6)用来组成酸、碱、盐三类物质至少需要的元素有__________(填写表中字母)。(3分) 查看习题详情和答案>>
(14分)下面是18×7的格子,按要求作答。
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
He |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
D |
|
|
|
|
E |
|
|
|
|
|
|
|
|
|
|
F |
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)用封闭的实线绘出元素周期表的轮廓。注意:不得使用铅笔作图。(3分)
(2)“大爆炸理论”指出:200亿年以前,宇宙中所有物质都包含在一个密度无限大,温度无限高的原始核中,由于某种原因它发生了爆炸,首先产生了中子、质子和电子,随后就产生了元素。你由此可知最先产生的元素是_______(填写元素名称)(1分),其中子数比质子数多1的核素的原子符号是_________;(1分)
(3)C、D、E、F的简单离子半径由小到大顺序是_______________________(填写离子符号);(2分)
(4)请用电子式表示出E和H形成的化合物形成过程:_____________________________;(2分)
(5)用实线绘出金属与非金属的分界线。注意:不得使用铅笔作图。(2分)
(6)用来组成酸、碱、盐三类物质至少需要的元素有__________(填写表中字母)。(3分)
查看习题详情和答案>>
(14分)已知CO2(g)+H2(g)CO(g)+H2O(g)的平衡常数随温度变化如下表:
| t/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
请回答下列问题:
(1)上述正向反应是________反应(选填“放热”或“吸热”)。
(2)若达平衡后降温,则平衡向________移动,CO2转化率________,正反应速率________(选填“增大”、“减小”或“不变”)。
(3)在850℃发生上述反应,以表中的物质的量投入恒容反应器中,其中向正反应方向移动的有________(选填A、B、C、D、E)
|
| A | B | C | D | E |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
(4)在850℃时,可逆反应:CO2(g)+H2(g)CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2O (mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
则3 min~4 min平衡后c3=______________,CO2的转化率为____________。
查看习题详情和答案>>