网址:http://m.1010jiajiao.com/timu3_id_385800[举报]
某校化学实验小组同学进行有关NO2气体的系列实验。
(1)如上图所示,烧瓶中放有少量铜片,打开分液漏斗
的旋塞,加入过量浓硝酸,烧瓶中产生气体的颜色是 ,试管中收集的气体颜色是 ,用化学方程式表示其原因 ;
(2)将烧瓶浸入冰水中,烧瓶内气体颜色 (填“变深”、“不变”或“变浅”),使用化学用语和必要的文字说明颜色变化的原因 ;
(3)在80℃时,将0.40 mol N2O4气体充入2 L已经抽空的固定容积的密闭容器中发生反应,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4)/mol | 0.40 | a | 0.20 | c | d | e |
| n(NO2)/mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
①计算a = ,此温度时该反应的平衡常数K= ;
②平衡后,向该容器中再充入0.2molN2O4气体,则N2O4的转化率 (填增大、减小或不变)
③改变条件使反应重新达到平衡,能使c(NO2)/c(N2O4)值变小的措施有(填序号) 。
A.增大N2O4的起始浓度 B.升高温度
C.使用高效催化剂 D.向混合气体中通入稀有气体
查看习题详情和答案>>
某校化学实验小组同学进行有关NO2气体的系列实验。

(1)如上图所示,烧瓶中放有少量铜片,打开分液漏斗
的旋塞,加入过量浓硝酸,烧瓶中产生气体的颜色是 ,试管中收集的气体颜色是 ,用化学方程式表示其原因 ;
(2)将烧瓶浸入冰水中,烧瓶内气体颜色 (填“变深”、“不变”或“变浅”),使用化学用语和必要的文字说明颜色变化的原因 ;
(3)在80℃时,将0.40 mol N2O4气体充入2 L已经抽空的固定容积的密闭容器中发生反应,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4)/mol |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2)/mol |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
①计算a = ,此温度时该反应的平衡常数K= ;
②平衡后,向该容器中再充入0.2molN2O4气体,则N2O4的转化率 (填增大、减小或不变)
③改变条件使反应重新达到平衡,能使c(NO2)/c(N2O4)值变小的措施有(填序号) 。
A.增大N2O4的起始浓度 B.升高温度
C.使用高效催化剂 D.向混合气体中通入稀有气体
查看习题详情和答案>>
(14分)某课外兴趣小组对双氧水(H2O2水溶液)做了如下实验探究。
(1)将质量相同但聚集状态不同的MnO2分别加入5mL 5%的双氧水中,并用带火星的木条试之。测定结果如下:
|
催化剂(MnO2) |
操作情况 |
观察结果 |
反应完成所需的时间 |
|
粉末状 |
混合不振荡 |
剧烈反应,使木条复燃 |
3.5分钟 |
|
块状 |
|
反应较慢,火星红亮但木条未复燃 |
30分钟 |
①写出H2O2反应的化学方程式 。
②实验结果说明催化剂作用的大小与 有关。
(2)取三份含有等量H2O2,但质量分数不同的双氧水,分别向其中加入1克MnO2粉末。测定结果如下:
|
双氧水体积 |
操作情况 |
反应完成所需的时间 |
收集到气体体积 |
反应后液体温度 |
|
a1%的150mL |
|
11分钟 |
539mL |
24℃ |
|
a2%的15mL |
混合不振荡 |
1分20秒 |
553mL |
56℃ |
|
a3%的7.5mL |
|
9秒 |
562mL |
67℃ |
请简要说明:
①反应完成所需的时间不同的原因 。
②反应后液体温度不同的原因 。
③收集到气体体积不同的原因 。
(3)向含有酚酞的NaOH稀溶液中,逐滴滴入10%的双氧水,红色褪去。
①已知双氧水显弱酸性,试写出H2O2的电离方程式: 。
②小组讨论红色褪去的原因时,甲同学认为是双氧水显酸性所致;乙同学认为是双氧水有较强氧化性所致。请你设计一个简单实验来说明是甲对还是乙对。(简要文字说明)
查看习题详情和答案>>
某课外兴趣小组对双氧水(H2O2水溶液)做了如下实验探究。
(1)将质量相同但聚集状态不同的MnO2分别加入5mL 5%的双氧水中,并用带火星的木条试之。测定结果如下:
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,使木条复燃 | 3.5分钟 |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
①写出H2O2反应的化学方程式 。
②实验结果说明催化剂作用的大小与 有关。
(2)取三份含有等量H2O2,但质量分数不同的双氧水,分别向其中加入1克MnO2粉末。测定结果如下:
| 双氧水体积 | 操作情况 | 反应完成所需的时间 | 收集到气体体积 | 反应后液体温度 |
| a1%的150mL | 11分钟 | 539mL | 24℃ | |
| a2%的15mL | 混合不振荡 | 1分20秒 | 553mL | 56℃ |
| a3%的7.5mL | 9秒 | 562mL | 67℃ |
请简要说明:
①反应完成所需的时间不同的原因 。
②反应后液体温度不同的原因 。
③收集到气体体积不同的原因 。
(3)向含有酚酞的NaOH稀溶液中,逐滴滴入10%的双氧水,红色褪去。
①已知双氧水显弱酸性,试写出H2O2的电离方程式: 。
②小组讨论红色褪去的原因时,甲同学认为是双氧水显酸性所致;乙同学认为是双氧水有较强氧化性所致。请你设计一个简单实验来说明是甲对还是乙对。(简要文字说明)
查看习题详情和答案>>氨有着广泛的用途,如可用于化肥、硝酸、合成纤维等工业生产。氨的水溶液中存在电离平衡,常用电离常数Kb和电离度α来定量表示其电离程度。Kb和α常用的测定方法:在一定温度时用酸度计测定一系列已知浓度氨水的pH,可得各浓度氨水对应的c(OH-),然后通过换算求得各对应的α值和Kb值。下面是某中学化学兴趣小组在25℃时测定一系列浓度氨水的pH所对应的c(OH-):
【仪器与试剂】酸度计、50 mL碱式滴定管、100mL烧杯、 0.10 mol·L-1氨水
【实验数据】(不必填表格)
| 烧杯号 | V氨水 (mL) | V水(mL) | c (NH3·H2O)(mol·L-1) | c(OH-) | Kb | α |
| 1 | 50.00 | 0.00 | | 1.34×10-3 | | |
| 2 | 25.00 | 25.00 | | 9.48×10-4 | | |
| 3 | 5.00 | 45.00 | | 4.24×10-4 | | |
(1)25℃时,氨水的电离常数:Kb
 ▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。
▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。(2)用0.10mol·L—1盐酸分别滴定20.00mL0.10mol·L—1的NaOH溶液和20.00mL0.10mol·L—1
氨水所得的滴定曲线如下:
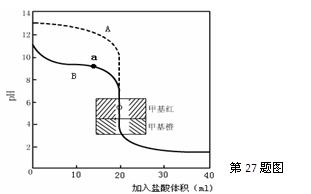
请指出盐酸滴定氨水的曲线为 ▲ (填A或B),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序 ▲ 。
(3)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧试验机中相关的反应有:
4NH3(g)+3O2(g)= 2N2(g)+6H2O(l) △H1 ①
4NH3(g)+5O2(g)= 4NO(g)+6H2O(l) △H2 ②
4NH3(g)+6NO(g)= 5N2(g)+6H2O(l) △H3 ③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= ▲ 。
(4)Allis-Chalmers制造公司发现可以用氨作为燃料电池的燃料。其总反应式为4NH3+3O2= 2N2+6H2O,正极上的电极反应式为O2+2H2O+4e—=4OH—,则负极上的电极反应式为 ▲ 。 查看习题详情和答案>>