摘要:13.向0.1 mol/L的NaOH溶液中加入0.1 mol/L的盐酸.若用X代表加入盐酸的体积.Y代表溶液中离子的总数.则下列曲线中正确的是 ( )
网址:http://m.1010jiajiao.com/timu3_id_385158[举报]
0.1 mol/L的CH3COOH溶液中存在平衡: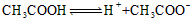 。下列说法正确的是
。下列说法正确的是
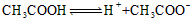 。下列说法正确的是
。下列说法正确的是 [ ]
A.加水时,平衡向逆反应方向移动
B.加入少量0.1 mol/L盐酸,溶液中c(H+)减小
C.加入少量NaOH固体,平衡向正反应方向移动
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看习题详情和答案>>
B.加入少量0.1 mol/L盐酸,溶液中c(H+)减小
C.加入少量NaOH固体,平衡向正反应方向移动
D.加入少量CH3COONa固体,平衡向正反应方向移动
某溶液中可能含有以下6种离子中的几种:NH4+、A13+、Mg2+、CO32-、Cl一、SO42-,为确认溶液组成,现取三份各 100 mL。溶液进行如下实验:
(1)向第一份溶液中加入 AgNO3溶液有沉淀产生;
(2)向第二份溶液中加入过量NaOH溶液充分反应后,最终得到沉淀0.58 g(经过滤、洗涤、干燥,下同),同时收集到气体0.03 mol(设气体全部从溶液中逸出);
(3)向第三份溶液中加入足量BaCl2溶液(盐酸酸化)充分反应后,得到沉淀6.99 g。
由此可知,下列关于原溶液组成的正确结论是
| A.一定存在A13+、M g2+、NH4+和SO42- | B.一定存在Cl一 |
| C.一定不存在Mg2+,可能存在A13+ | D.溶液中SO42-的浓度是0.03 mol/L |
某溶液中可能含有以下6种离子中的几种:NH4+、A13+、Mg2+、CO32-、Cl一、SO42-,为确认溶液组成,现取三份各 100 mL。溶液进行如下实验:
(1)向第一份溶液中加入 AgNO3溶液有沉淀产生;
(2)向第二份溶液中加入过量NaOH溶液充分反应后,最终得到沉淀0.58 g(经过滤、洗涤、干燥,下同),同时收集到气体0.03 mol(设气体全部从溶液中逸出);
(3)向第三份溶液中加入足量BaCl2溶液(盐酸酸化)充分反应后,得到沉淀6.99 g。
由此可知,下列关于原溶液组成的正确结论是
A.一定存在A13+、M g2+、NH4+和SO42- B.一定存在Cl一
C.一定不存在Mg2+,可能存在A13+ D.溶液中SO42-的浓度是0.03 mol/L
查看习题详情和答案>>
某溶液中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol/L。
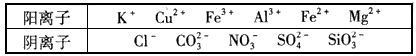
某学习兴趣小组欲探究该溶液的组成,进行了如下实验:
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察);
Ⅱ.取少量溶液,加入KSCN溶液无明显变化;
Ⅲ.另取少量溶液,加入少量盐酸,有气体生成;
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
(1)判断原溶液中是否含有CO32-,答___;判断理由是___。
(2)原溶液中可能含有的离子是__,肯定不含有的离子是___(写离子符号)。
(3)Ⅳ中反应的离子方程式是___。
(4)另取100 mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为1.6 g,则原溶液中一定含有的离子是___(写离子符号)。
查看习题详情和答案>>
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察);
Ⅱ.取少量溶液,加入KSCN溶液无明显变化;
Ⅲ.另取少量溶液,加入少量盐酸,有气体生成;
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
(1)判断原溶液中是否含有CO32-,答___;判断理由是___。
(2)原溶液中可能含有的离子是__,肯定不含有的离子是___(写离子符号)。
(3)Ⅳ中反应的离子方程式是___。
(4)另取100 mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为1.6 g,则原溶液中一定含有的离子是___(写离子符号)。



