摘要:4.将SO2通入CuSO4和NaCl的浓溶液中.溶液颜色变浅.析出白色沉淀.取该沉淀分析.知其中含Cl:35.7%.Cu:64.3%.SO2在上述反应中作用是 ( ) A.酸 B.漂白剂 C.还原剂 D.氧化剂
网址:http://m.1010jiajiao.com/timu3_id_38510[举报]
将SO2通入CuSO4和NaCl的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀分析,知其中含Cl:35.7%,Cu:64.3%,SO2在上述反应中作用是
A.酸性 B.漂白剂 C.还原剂 D.氧化剂
查看习题详情和答案>>硫代硫酸钠是一种常见的化工原料.将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是 .
(2)用该方法获得的Na2S2O3.H2O晶体中常混有一定量的杂质.某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水).
[提出假设]
假设1:晶体中只含Na2CO3杂质
假设2:晶体中只含Na2S杂质
假设3:
[查阅资料]
①SO2+2H2S═3S↓+2H2O
②Na2S2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:
Na2S2O3+H2SO4═Na2SO4+S↑+SO2↑+H2O
③CuSO4+H2S=CuS↓(黑色)+H2SO4
[判断与思考]
某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立.你认为其结论是否合理? (填“合理”、“不合理”)并说明理由:
[设计方案进行实验]
基于假设1,完成下表实验方案、现象及结论(仪器自选).
限选实验试剂:3mol?L-1H2SO4、1mol?L-1NaOH、酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
(3)已知:2Na2S2O3+I2═2NaI+Na2S4O6.为测定所制得晶体的纯度,该小组以淀粉作指示剂,
用0.010mol?L-1的碘水进行多次取样滴定,测得Na2S2O3?5H2O的含量约为102%.若所用试剂及操作均无不当,产生该结果最可能的原因是 .
查看习题详情和答案>>
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是
(2)用该方法获得的Na2S2O3.H2O晶体中常混有一定量的杂质.某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水).
[提出假设]
假设1:晶体中只含Na2CO3杂质
假设2:晶体中只含Na2S杂质
假设3:
[查阅资料]
①SO2+2H2S═3S↓+2H2O
②Na2S2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:
Na2S2O3+H2SO4═Na2SO4+S↑+SO2↑+H2O
③CuSO4+H2S=CuS↓(黑色)+H2SO4
[判断与思考]
某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立.你认为其结论是否合理?
[设计方案进行实验]
基于假设1,完成下表实验方案、现象及结论(仪器自选).
限选实验试剂:3mol?L-1H2SO4、1mol?L-1NaOH、酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
| 实验方案 | 现象及结论 |
用0.010mol?L-1的碘水进行多次取样滴定,测得Na2S2O3?5H2O的含量约为102%.若所用试剂及操作均无不当,产生该结果最可能的原因是
(2010?卢湾区二模)高锰酸钾在不同的条件下发生还原反应如下:
MnO4-+5e+8H+→Mn2++4H2O
MnO4-+3e+2H2O→MnO2↓+4OH-
MnO4-+e→MnO42-(溶液绿色)
(1)从上述三个半反应中可以看出高锰酸根离子还原产物受到溶液的
(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为
(3)将PbO2投入到MnSO4酸性溶液中搅拌溶液变为紫红色.下列说法正确的是
a.氧化性:PbO2>KMnO4 b.还原性:PbO2>KMnO4 c.该反应可以用盐酸酸化
(4)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量比为3:2.完成下列化学方程式,并标出电子转移的方向和数目.
若生成5.44g单质硫,反应过程中转移的电子数约为
查看习题详情和答案>>
MnO4-+5e+8H+→Mn2++4H2O
MnO4-+3e+2H2O→MnO2↓+4OH-
MnO4-+e→MnO42-(溶液绿色)
(1)从上述三个半反应中可以看出高锰酸根离子还原产物受到溶液的
酸碱性
酸碱性
影响.(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为
MnO4-
MnO4-
→Mn2+
Mn2+
.(3)将PbO2投入到MnSO4酸性溶液中搅拌溶液变为紫红色.下列说法正确的是
a
a
.a.氧化性:PbO2>KMnO4 b.还原性:PbO2>KMnO4 c.该反应可以用盐酸酸化
(4)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量比为3:2.完成下列化学方程式,并标出电子转移的方向和数目.
28
28
KMnO4+5
5
K2S+24KOH
24KOH
→28
28
K2MnO4+3
3
K2SO4+2
2
S↓+12H2O
12H2O
若生成5.44g单质硫,反应过程中转移的电子数约为
2.38NA
2.38NA
;若反应中有22mol电子转移,则生成K2SO4和S的物质的量比为3:2
3:2
.(2012?邯郸一模)测定转化成SO3的转化率可以用如图装置,装置中烧瓶内发生的化学反应方程式为:
Na2SO3(s)+H2SO4(85%)=Na2SO4+H2O+SO2↑(已知S03的熔点是16.8℃,沸点是44.8℃)
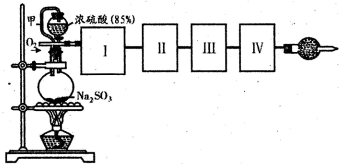
(1)装置中甲管的作用是
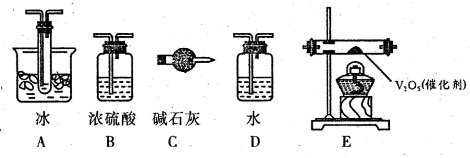
(2)根据实验需要,应该在I、II、III、IV处连接合适的装置,请从题图A?E装置中选择最适合装置并将其序号填放下面的空格中.I、II、III、IV处连接的装置分别是
(3)为使SO2有较高的转化率,实验中加热催化剂与滴加浓硫酸的顺序中,应采取的操作是
(4)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因(可以不填满)①原因:
(5)将SO2通入含1mol氯酸的溶液中,可生成一种强酸和一种氧化物,并有6.02×1023个电子转移,则该反应的化学方程式为
(6)用nmolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2-段时间后,测得装置IV增重了 mg,则实验中SO2的转化率为
×100%
×100%.(用含m、n的代数式填写)
查看习题详情和答案>>
Na2SO3(s)+H2SO4(85%)=Na2SO4+H2O+SO2↑(已知S03的熔点是16.8℃,沸点是44.8℃)

(1)装置中甲管的作用是
让硫酸顺利滴下
让硫酸顺利滴下
.(2)根据实验需要,应该在I、II、III、IV处连接合适的装置,请从题图A?E装置中选择最适合装置并将其序号填放下面的空格中.I、II、III、IV处连接的装置分别是
BEAC
BEAC

(3)为使SO2有较高的转化率,实验中加热催化剂与滴加浓硫酸的顺序中,应采取的操作是
先加热催化剂再滴入浓硫酸
先加热催化剂再滴入浓硫酸
,若用大火加热烧瓶时,SO2的转化率会降低
降低
(填“升高”、“不变”或“降低”).(4)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因(可以不填满)①原因:
Na2SO3变质
Na2SO3变质
②原因:浓硫酸的浓度不够
浓硫酸的浓度不够
③原因:其它合理答案也可
其它合理答案也可
(5)将SO2通入含1mol氯酸的溶液中,可生成一种强酸和一种氧化物,并有6.02×1023个电子转移,则该反应的化学方程式为
SO2+2HClO3═H2SO4+2ClO2
SO2+2HClO3═H2SO4+2ClO2
(6)用nmolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2-段时间后,测得装置IV增重了 mg,则实验中SO2的转化率为
| 64n-m |
| 64n |
| 64n-m |
| 64n |
用下图装置可以进行测定SO2转化成SO3的转化率的实验.已知SO3的熔点是16,8℃,沸点是445.8℃.已知发生装置中所涉及反应的化学方程式为:Na2SO3(s)+H2SO4(98%)═Na2SO4+H2O+SO2↑
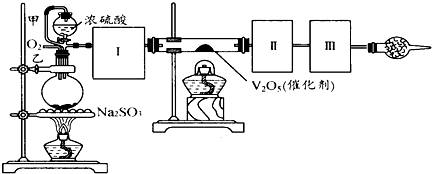
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置.请从下图A~E装置中选择最适合装置并将其序号填入下面的空格中.
Ⅰ、Ⅱ、Ⅲ处连接的装置分别是

(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作是
(3)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式
(4)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为
%(用含a、b的代数式填写)
(5)尾端球形干燥管的作用是
查看习题详情和答案>>

(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置.请从下图A~E装置中选择最适合装置并将其序号填入下面的空格中.
Ⅰ、Ⅱ、Ⅲ处连接的装置分别是
B
B
、A
A
、E(或C)
E(或C)
.
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作是
先加热催化剂再滴入浓硫酸
先加热催化剂再滴入浓硫酸
.(3)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式
SO2+2HClO3=H2SO4+2ClO2
SO2+2HClO3=H2SO4+2ClO2
(4)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为
| 1600a-25b |
| 16a |
| 1600a-25b |
| 16a |
(5)尾端球形干燥管的作用是
防止空气中的CO2及水蒸气干扰,造成误差
防止空气中的CO2及水蒸气干扰,造成误差
.