网址:http://m.1010jiajiao.com/timu3_id_38389[举报]
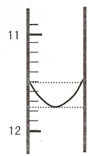 某混合碱是①Na2CO3和NaHCO3 或②Na2CO3和 NaOH.用“双指示剂法”对样品的组分和总碱量[n(Na2O)]进行测定.实验方案:称取 0.2960g 样品配成 500mL 溶液,取25.00mL置于250mL 锥形瓶中,加适量蒸馆水和几滴酚酞,用0.0100mol?L-1 的盐酸标准溶液将混合碱滴定成NaHCO3,然后再用溴甲酚绿--二甲基黄为指示剂进行滴定,将NaHCO3完全中和.
某混合碱是①Na2CO3和NaHCO3 或②Na2CO3和 NaOH.用“双指示剂法”对样品的组分和总碱量[n(Na2O)]进行测定.实验方案:称取 0.2960g 样品配成 500mL 溶液,取25.00mL置于250mL 锥形瓶中,加适量蒸馆水和几滴酚酞,用0.0100mol?L-1 的盐酸标准溶液将混合碱滴定成NaHCO3,然后再用溴甲酚绿--二甲基黄为指示剂进行滴定,将NaHCO3完全中和.(1)某同学平行滴定了三次,每次滴定从“0“点开始读数,其中第 I 次滴定的第一个终点的液面如图所示,请读出实验数据,填入下列表格中
| 序号 | 第一滴定终点的读数(V1/mL) | 第二滴定终点的读数(V2/mL) |
| I | ? | 26.85 |
| II | 10.02 | 25.02 |
| III | 9.98 | 24.98 |
(3)将混合碱滴定成NaHCO3的过程中,为了结果更加准确,应始终逐滴滴加,这样操作的原因是
(4)上述碱样中总碱量[n(Na2O)]是多少?写出计算过程
(5)如果本实验只测定样品的总碱量,实验方案应该怎样设计:
某混合碱是①Na2CO3和NaHCO3 或② Na2CO3和 NaOH。用“ 双指示剂法”对样品的组分和总碱量 [n (Na2O) ] 进行测定。实验方案:称取 0.2960g 样品配成 500mL 溶液,取25.00mL置于250mL 锥形瓶中,加适量蒸馆水和几滴酚酞,用0.0100 mol??L-1 的盐酸标准溶液将混合碱滴定成NaHCO3,然后再用溴甲酚绿——二甲基黄为指示剂进行滴定,将NaHCO3完全中和。
(1)某同学平行滴定了三次,每次滴定从 "0" 点开始读数,其中第 I 次滴定的第一个终点的液面如右图所示,请读出实验数据,填入下列表格中
| 序号 | 第一滴定终点的读数(V1/mL) | 第二滴定终点的读数(V2/mL) |
| I | ? | 26.85 |
| II | 10.02 | 25.02 |
| III | 9.98 | 24.98 |
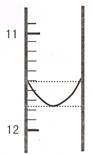
(2)该混合碱样品的组成为 ,理由 。
(3)将混合碱滴定成NaHCO3的过程中,为了结果更加准确,应始终逐滴滴加,这样操作的原因是 。
(4)上述碱样中总碱量[n (Na2O) ]是多少?写出计算过程
。
(5)如果本实验只测定样品的总碱量,实验方案应该怎样设计:
。
查看习题详情和答案>>某混合碱是①Na2CO3和NaHCO3 或② Na2CO3和 NaOH。用“ 双指示剂法”对样品的组分和总碱量 [n (Na2O) ] 进行测定。实验方案:称取 0.2960g 样品配成 500mL 溶液,取25.00mL置于250mL 锥形瓶中,加适量蒸馏水和几滴酚酞,用0.0100 mol•L-1 的盐酸标准溶液将混合碱滴定成NaHCO3,然后再用溴甲酚绿――二甲基黄为指示剂进行滴定,将NaHCO3完全中和。
(1)某同学平行滴定了三次,每次滴定从 "0" 点开始读数,其中第 I 次滴定的第一个终点的液面如下图所示,请读出实验数据,填入下列表格中
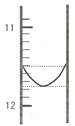
| 序号 | 第一滴定终点的读数(V1/mL) | 第二滴定终点的读数(V2/mL) |
| I | ? | 26.85 |
| II | 10.02 | 25.02 |
| III | 9.98 | 24.98 |
(2)该混合碱样品的组成为 ,理由 。
(3)将混合碱滴定成NaHCO3的过程中,为了结果更加准确,应始终逐滴滴加,这样操作的原因是 。
(4)上述碱样中总碱量[n (Na2O) ]是多少?写出计算过程
。
(5)如果本实验只测定样品的总碱量,实验方案应该怎样设计:
。
查看习题详情和答案>>某混合碱是①Na2CO3和NaHCO3或②Na2CO3和NaOH.用“双指示剂法”对样品的组分和总碱量[n(Na2O)]进行测定.实验方案:称取0.2960 g样品配成500 mL溶液,取25.00 mL置于250 mL锥形瓶中,加适量蒸馏水和几滴酚酞,用0.0100 mol·L-1的盐酸标准溶液将混合碱滴定成NaHCO3,然后再用溴甲酚绿——二甲基黄为指示剂进行滴定,将NaHCO3完全中和.
(1)某同学平行滴定了三次,每次滴定从"0点开始读数,其中第Ⅰ次滴定的第一个终点的液面如图所示,请读出实验数据,填入下列表格中


(2)该混合碱样品的组成为________,理由________.
(3)将混合碱滴定成NaHCO3的过程中,为了结果更加准确,应始终逐滴滴加,这样操作的原因是________.
(4)上述碱样中总碱量[n(Na2O)]是多少?写出计算过程________.
(5)如果本实验只测定样品的总碱量,实验方案应该怎样设计:________.