摘要:如图.在劲度为k的轻弹簧两端分别固定有两个相同的木块P.Q.质量均为m.开始系统静止在水平桌面上.用竖直向下的力F缓慢向下压P木块到某一位置.系统又处于静止.这时突然撤去压力F.发现P木块开始做简谐运动.而Q木块恰好始终没有离开水平面. 求:(1)P做简谐运动的振幅A. (2)振动过程中P的最大加速度am. (3)在缓慢向下压P的过程中压力F所做的功W.
网址:http://m.1010jiajiao.com/timu3_id_38328[举报]
I.已知:C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别如下:
C(s)+O2(g)=CO2(g)△H=-394kJ/mol①
2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol②
2H2(g)+O2(g)=2H2O(g)△H=-484kl/mol③
(1)试写出由C(s)与水蒸气在高温条件下反应生成氢气和一氧化碳的热化学方程式:______________________。
(2)若利用上述反应②设计一个燃料电池,如用氢氧化钾溶液作电解质溶液,用多孔石墨作电极,写出负极的电极反应式:________________。
Ⅱ.如图所示,横坐标为溶液的pH,纵坐标为Al3+或[Al(OH)4]-的物质的量浓度的对数,回答下列问题。
C(s)+O2(g)=CO2(g)△H=-394kJ/mol①
2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol②
2H2(g)+O2(g)=2H2O(g)△H=-484kl/mol③
(1)试写出由C(s)与水蒸气在高温条件下反应生成氢气和一氧化碳的热化学方程式:______________________。
(2)若利用上述反应②设计一个燃料电池,如用氢氧化钾溶液作电解质溶液,用多孔石墨作电极,写出负极的电极反应式:________________。
Ⅱ.如图所示,横坐标为溶液的pH,纵坐标为Al3+或[Al(OH)4]-的物质的量浓度的对数,回答下列问题。
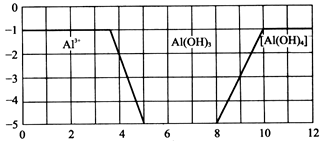
(3)往0.1mol/L的AlCl3溶液中加入氨水,调节溶液的pH 为6,反应的离子方程式为_____________________;此时改加NaOH溶液,至溶液的pH=10,反应的离子方程式可以表示为_________________。
(4)某溶液中含有Al3+,为提纯Al3+可以控制溶液的pH范围为______________。
(5)从图中选取适当的数据计算Al(OH)3的溶度积(Ksp)=________________
(6)用石墨电极电解AlCl3溶液,试写出电解初始阶段的化学方程式:______________。
查看习题详情和答案>>
(4)某溶液中含有Al3+,为提纯Al3+可以控制溶液的pH范围为______________。
(5)从图中选取适当的数据计算Al(OH)3的溶度积(Ksp)=________________
(6)用石墨电极电解AlCl3溶液,试写出电解初始阶段的化学方程式:______________。
(2013?广安模拟)已知:
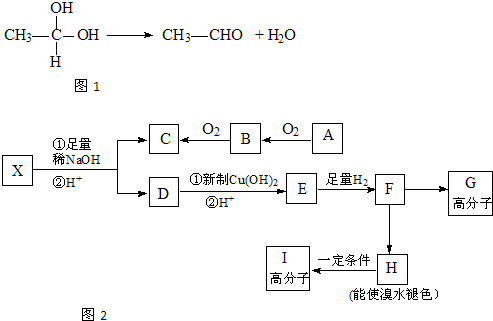
①如图1,在稀碱溶液中,溴苯难发生水解
②如图2,现有分子式为C10H10O2Br2的芳香族化合物X,其苯环上的一溴代物只有一种,其核磁共振氢谱图中有四个吸收峰,吸收峰的面积比为1:2:6:1,在一定条件下可发生下述一系列反应,其中C能发生银镜反应,E遇FeCl3溶液显色且能与浓溴水反应.
请回答下列问题:
(1)X中官能的名称是
(2)F→H的反应类型是
(3)I的结构简式为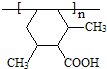
 ;
;
(4)E不具有的化学性质
a.取代反应 b.消去反应 c.氧化反应 d.1molE最多能与2molNaHCO3反应
(5)写出下列反应的化学方程式:
①X与足量稀NaOH溶液共热的化学方程式:
 ;
;
②F→G的化学方程式: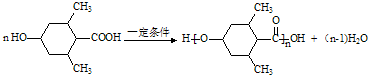
 ;
;
(6)同时符合下列条件的E的同分异构体共有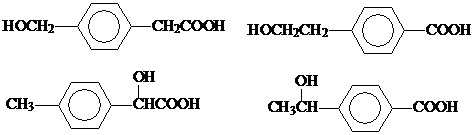
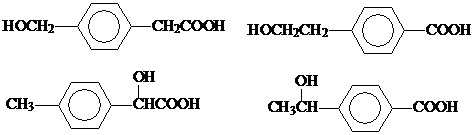 .
.
a.苯环上核磁共振氢谱有两种 b.不能发生水解反应
c.遇FeCl3溶液不显色 d.1molE最多能分别与1molNaOH和2molNa反应.
查看习题详情和答案>>

①如图1,在稀碱溶液中,溴苯难发生水解
②如图2,现有分子式为C10H10O2Br2的芳香族化合物X,其苯环上的一溴代物只有一种,其核磁共振氢谱图中有四个吸收峰,吸收峰的面积比为1:2:6:1,在一定条件下可发生下述一系列反应,其中C能发生银镜反应,E遇FeCl3溶液显色且能与浓溴水反应.
请回答下列问题:
(1)X中官能的名称是
酯基和溴原子
酯基和溴原子
.(2)F→H的反应类型是
消去
消去
.(3)I的结构简式为


(4)E不具有的化学性质
bd
bd
(选填序号)a.取代反应 b.消去反应 c.氧化反应 d.1molE最多能与2molNaHCO3反应
(5)写出下列反应的化学方程式:
①X与足量稀NaOH溶液共热的化学方程式:


②F→G的化学方程式:


(6)同时符合下列条件的E的同分异构体共有
4
4
种,其中一种的结构简式为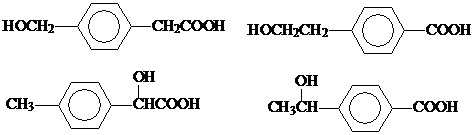
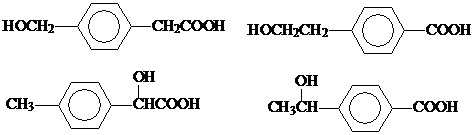
a.苯环上核磁共振氢谱有两种 b.不能发生水解反应
c.遇FeCl3溶液不显色 d.1molE最多能分别与1molNaOH和2molNa反应.
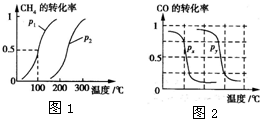 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题:(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L)中,在一定条件下发生反应:
CH4(g)+H2O(g)?CO(g)+3H2(g)(Ⅰ)
CH4的转化率与温度、压强的关系如图1所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
0.0030mol?L-1?min-1
0.0030mol?L-1?min-1
.②图中的p1
<
<
p2(填“<”、“>”或“=”),100℃时的平衡常数为2.25×10-4
2.25×10-4
.③该反应的△H
>
>
0,△S>
>
0(填“<”、“>”或“=”).(2)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:
CO(g)+2H2(g)?△H<0 (Ⅱ)
①若容器的容积不变,下列措施可增大甲醇产率的是
BD
BD
(填序号).A.升高温度
B.将CH3OH(g)从体系中分离出来
C.恒容下充入He,使体系的总压强增大
D.再充入a mol CO和3a mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了下面的实验设计表中.
| 实验编号 | T(℃) | n(CO)/n(H2) | ρ(MPa) | ||
| 1 | 150 |
|
0.1 | ||
| 2 | n |
|
5 | ||
| 3 | 350 | m | 5 |
150
150
,m=| 1 |
| 3 |
| 1 |
| 3 |
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线,请指明图2中的压强px=
0.1
0.1
MPa.(1)纳米级Cu2O具有优良的催化性能,下列为制取Cu2O的三种方法;
【方法1】:用炭粉高温还原CuO:2CuO+C
Cu2O+CO
已知:2Cu(s)+
O2(g)=Cu2O(s)△H1=-169kJ?mol-1
C(s)+
O2(g)=CO(g)△H2=-110.5kJ?mol-1
Cu(s)+
O2(g)=CuO(s)△H3=-157kJ?mol-1
则该方法的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g)中;△H= kJ?mol-1.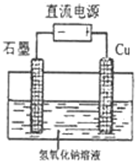
【方法II】:电解法:基于绿色化学理念设计的制取Cu2O的电解池示意图如图,其中电解液为浓的氢氧化钠溶液,总反应为:2Cu+H2O
Cu2O+H2↑
该电解池阳极的电极反应 .
【方法III】:加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备CU2O,同时放出N2,其化学反应方程式 .
(2)在相同的密闭容器中,用以上方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)
2H2(g)+O2(g)△H>0
水蒸气的浓度随时间t变化如下表:
A.实验的温度:T2 T1(填“<”或“>”)
B.实验①前20min的平均反应速率为 mol?L-1?min-1.
C.实验②比实验①中所用的催化剂催化效率 (填“高”或“低”)
D.实验②中水蒸气的转化率为 .
查看习题详情和答案>>
【方法1】:用炭粉高温还原CuO:2CuO+C
| ||
已知:2Cu(s)+
| 1 |
| 2 |
C(s)+
| 1 |
| 2 |
Cu(s)+
| 1 |
| 2 |
则该方法的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g)中;△H=

【方法II】:电解法:基于绿色化学理念设计的制取Cu2O的电解池示意图如图,其中电解液为浓的氢氧化钠溶液,总反应为:2Cu+H2O
| ||
该电解池阳极的电极反应
【方法III】:加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备CU2O,同时放出N2,其化学反应方程式
(2)在相同的密闭容器中,用以上方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)
| 光照 |
| Cu2O |
水蒸气的浓度随时间t变化如下表:
| 序号 | t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| C/mol-1 | |||||||
| 温度/℃ | |||||||
| ① | T1 | 0.500 | 0.492 | 0.486 | 0.482 | 0.480 | 0.480 |
| ② | T1 | 0.500 | 0.488 | 0.484 | 0.480 | 0.480 | 0.480 |
| ③ | T2 | 0.500 | 0.450 | 0.450 | 0.450 | 0.450 | 0.450 |
B.实验①前20min的平均反应速率为
C.实验②比实验①中所用的催化剂催化效率
D.实验②中水蒸气的转化率为
 (2011?奉贤区一模)如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
(2011?奉贤区一模)如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )