网址:http://m.1010jiajiao.com/timu3_id_382895[举报]
| |||||||||||||||
(1)现用物质的量浓度为amol/L的标准盐酸去测定VmLNaOH溶液的物质的量浓度,请填写下列空白:
①酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
②下图是酸式滴定管中液面在滴定前后的读数,则被测NaOH溶液的的物质的量浓度为:c(NaOH)= ________________。
③若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测得的NaOH溶液的物质的量浓度会偏_________________。
(2)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。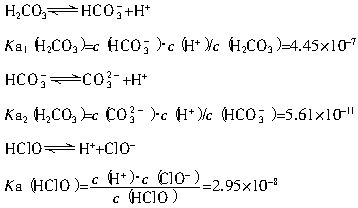
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将过量的氯气通入到少量的碳酸钠溶液中______________________________________;
②氯气和碳酸钠按照1∶1的比例恰好反应_____________________________________。
(3)铬是1979年法国化学家沃克兰在分析铬铅矿时首先发现的。铬位于周期表中第四周期ⅥB族,其主要化合价为+6、+3、+2,其中+3较为稳定。某兴趣小组对铬的化合物进行探究性研究发现:Cr2O3微溶于水,与A12O3类似,是两性氧化物;Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡。Cr(OH)3酸式电离的电离方程式是:_________。
(16分)Ⅰ.下列有关实验操作中,合理的是______________(填序号) 。
A.用托盘天平称取11.70g食盐 B.用量筒量取12.36mL盐酸
C.用酸式滴定管量取21.20mL0.10mol/L H2SO4溶液
D.用200mL容量瓶配制500mL0.1mol/L NaCl溶液
E.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较
Ⅱ.现用物质的量浓度为amol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
(2)下图是酸式滴定管中液面在滴定前后的读数:c (NaOH) = _____mol/L。
(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度______。(选“偏大”“偏小”“不变”)
III.如图是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
曲线a是用 溶液滴定 溶液;曲线b是用 溶液滴定 溶液;P点的坐标为( );盐酸的物质的量浓度为 mol/L。
查看习题详情和答案>>
(10分)现用物质的量浓度为amol·L-1的标准NaOH溶液去滴定VmL盐酸的物质的量浓度,请填写下列空白:
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是________________________。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 (选填“甲”或“乙”)中。
(3)右图是碱式滴定管中液面在滴定前后的读数, c(HCl)=_______________mol·L-1。
(4)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定 管尖嘴部分气泡消失,则滴定的HCl物质的量浓度会偏____________(填“大”或“小”)。
(5)取20.00mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度(mol·L-1) | 滴定完成时, NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的标志是______________________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)。
查看习题详情和答案>>
(10分)现用物质的量浓度为amol·L-1的标准NaOH溶液去滴定VmL盐酸的物质的量浓度,请填写下列空白:
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是________________________。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 (选填“甲”或“乙”)中。
(3)右图是碱式滴定管中液面在滴定前后的读数, c(HCl)=_______________mol·L-1。
(4)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则滴定的HCl物质的量浓度会偏____________(填“大”或“小”)。
(5)取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度(mol·L-1) | 滴定完成时, NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的标志是______________________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)。 查看习题详情和答案>>
