摘要:H2S.HI.FeCl2.浓H2SO4.Na2SO3.苯酚等溶液在空气中久置因发生氧化还原反应而变质
网址:http://m.1010jiajiao.com/timu3_id_38209[举报]
下列陈述Ⅰ、Ⅱ都正确并且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 浓硫酸有强氧化性 | 浓硫酸不能用于干燥H2S和HI气体 |
| B | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
| D | SiO2是两性氧化物 | SiO2能与NaOH溶液和氢氟酸反应 |
| A、A | B、B | C、C | D、D |
(2012?绵阳模拟)含硫化氢的工业废气要经过治理方能排放,既回收硫单质又防止大气污染.请根据如下治理方法回答相关问题.
(1)电解法治理硫化氢的工艺流程如下:
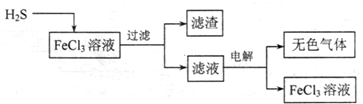
①FeCl3溶液吸收H2S的生成物是
②用惰性电极电解滤液时,阴极的电极反应式为
(2)富玛克斯法治理硫化氢的方法和步骤如下:
a.用2%?3%的Na2CO3溶液吸收含H2S的废气,反应生成2种酸式盐;
b.向上述反应所得溶液中加入液体R-NO(R表示一种芳香烃基),发生如下反应:R-NO+NaHS+H2O→R-NHOH+NaOH+S↓
C.步骤b生成的NaOH在溶液中与另一种酸式盐反应生成正盐;
d.R-NHOH与空气中的氧气反应又得到R-NO.
①写出上述a、c两步反应的离子方程式
②在上述治理硫化氢的全过程中,总反应的化学方程式是
(3)上述两种治理方法的共同优点是
查看习题详情和答案>>
(1)电解法治理硫化氢的工艺流程如下:

①FeCl3溶液吸收H2S的生成物是
FeCl2、HCl和S(或答氯化亚铁、盐酸和硫单质)
FeCl2、HCl和S(或答氯化亚铁、盐酸和硫单质)
②用惰性电极电解滤液时,阴极的电极反应式为
2H++2e-═H 2↑
2H++2e-═H 2↑
,电解总反应的离子方程式是2Fe2++2H+
2Fe3++H 2↑
| ||
2Fe2++2H+
2Fe3++H 2↑
| ||
(2)富玛克斯法治理硫化氢的方法和步骤如下:
a.用2%?3%的Na2CO3溶液吸收含H2S的废气,反应生成2种酸式盐;
b.向上述反应所得溶液中加入液体R-NO(R表示一种芳香烃基),发生如下反应:R-NO+NaHS+H2O→R-NHOH+NaOH+S↓
C.步骤b生成的NaOH在溶液中与另一种酸式盐反应生成正盐;
d.R-NHOH与空气中的氧气反应又得到R-NO.
①写出上述a、c两步反应的离子方程式
CO32-+H2S═HS-+HCO3-
CO32-+H2S═HS-+HCO3-
、HCO3-+OH-═CO32-+H 2O
HCO3-+OH-═CO32-+H 2O
.②在上述治理硫化氢的全过程中,总反应的化学方程式是
2H 2S+O 2
2S↓+2H 2O
| ||
2H 2S+O 2
2S↓+2H 2O
,若某工厂每天需要处理含H2S 10%的废气1800m3,在步骤d中理论上消耗空气
| ||
450
450
m3(空气中O2的体积百分含量以20%计算,所有气体体积均在标准状况下测得).(3)上述两种治理方法的共同优点是
吸收剂可循环使用
吸收剂可循环使用
.