摘要:⑴左:NaBr3/NaBr 右:Na2S2/Na2S4 ⑵阳极:3NaBr-2e-=NaBr3+2Na+(或3Br--2e-=Br3-) 阴极:Na2S4+2Na++2e-=2Na2S2(或S42-+2e-=2S22-) ⑶2Na2S2+NaBr3Na2S4+3NaBr ⑷Na+的流向为从左到右.
网址:http://m.1010jiajiao.com/timu3_id_378195[举报]
下图曲线为某固体饱和溶液浓度随温度变化的情况(该固体从溶液中析出时不带结晶水).下列判断错误的是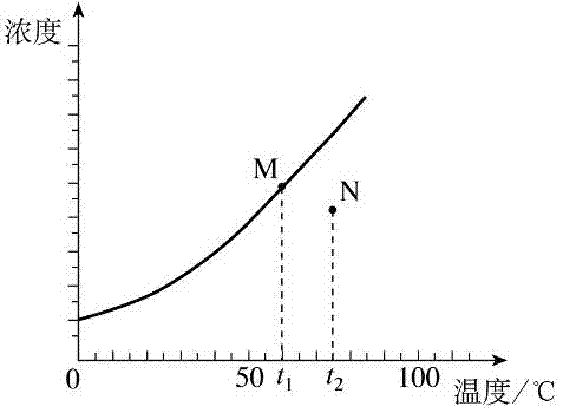 高考
高考
A. 都升温10℃后,M、N点均向右平移高考资源网
B. 加水稀释(假设温度都不变)时,M、N点均垂直向下移动高考资源网
C. 都降温10℃后,M点沿曲线向左下移,N点向左平移至曲线高考资源网
D. 恒温蒸发溶剂至均有晶体析出,则M点不动,N点垂直向上直至曲线相交网
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
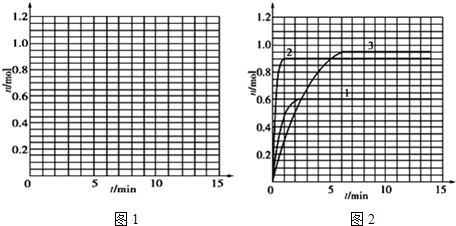
(1)根据左表中数据,在图1中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线: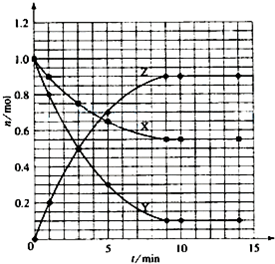

(2)体系中发生反应的化学方程式是
(3)列式计算该反应在0-3min时间内产物Z的平均反应速率:
(4)该反应达到平衡时反应物X的转化率α等于
(5)如果该反应是放热反应.改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如图2所示)则曲线①、②、③所对应的实验条件改变分别是:①
查看习题详情和答案>>
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

(1)根据左表中数据,在图1中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:


(2)体系中发生反应的化学方程式是
X+2Y?2Z
X+2Y?2Z
;(3)列式计算该反应在0-3min时间内产物Z的平均反应速率:
0.083mol?L-1?min-1
0.083mol?L-1?min-1
;(4)该反应达到平衡时反应物X的转化率α等于
45%
45%
;(5)如果该反应是放热反应.改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如图2所示)则曲线①、②、③所对应的实验条件改变分别是:①
升高温度
升高温度
②加入催化剂
加入催化剂
③增大压强
增大压强
.(2013?临沂三模)无水氯化铝是一种重要的化工原料,利用明矾石[K2SO4?Al2(SO4)3?2Al2O3?6H2O]制备无水氯化铝的流程如下:
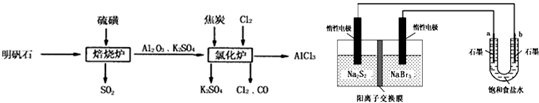
(1)焙烧炉中产生的SO2直接排放到空气中会形成酸雨,若某地酸雨的pH为4.6,在空气中放置一段时间后,pH变为4.0,其原因为
(2)氯化炉中发生的主要反应为:2Al2O3(s)+6Cl2(g)?4AlCl3(g)+3O2(g)△H>0.反应达平衡时,加焦炭能使平衡向正反应方向移动,理由是
(3)生产氯化铝的过程中会产生SO2、Cl2等大气污染物,若将二者按照一定比例通入水中可减少或消除污染.试设计简单实验检验二者是否恰好完全反应.(简要描述实验步骤、现象和结论)
仪器自选,可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(4)工业上利用如下装置制备氯气:已知左侧原电池的工作原理为:2Na2S2+NaBr3
Na2S4+3NaBr
①用惰性电极电解饱和食盐水的化学方程式为
②如图所示原电池放电时,电池中的Na+向
③该原电池工作一段时间后,测得左槽中Na+物质的量由a mol变为b mol,则电解池中b电极上得到的气体在标准状况下的体积为
查看习题详情和答案>>

(1)焙烧炉中产生的SO2直接排放到空气中会形成酸雨,若某地酸雨的pH为4.6,在空气中放置一段时间后,pH变为4.0,其原因为
酸雨中的弱酸亚硫酸被氧化为强酸硫酸,使溶液中的c(H+)增大,pH减小
酸雨中的弱酸亚硫酸被氧化为强酸硫酸,使溶液中的c(H+)增大,pH减小
;(用必要的文字简述).(2)氯化炉中发生的主要反应为:2Al2O3(s)+6Cl2(g)?4AlCl3(g)+3O2(g)△H>0.反应达平衡时,加焦炭能使平衡向正反应方向移动,理由是
焦炭可消耗产物中的氧气,使c(O2)变小;且放出热量,温度升高,导致平衡向正反应方向移动
焦炭可消耗产物中的氧气,使c(O2)变小;且放出热量,温度升高,导致平衡向正反应方向移动
.(3)生产氯化铝的过程中会产生SO2、Cl2等大气污染物,若将二者按照一定比例通入水中可减少或消除污染.试设计简单实验检验二者是否恰好完全反应.(简要描述实验步骤、现象和结论)
取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应;否则,二者未完全反应
取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应;否则,二者未完全反应
.仪器自选,可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(4)工业上利用如下装置制备氯气:已知左侧原电池的工作原理为:2Na2S2+NaBr3
| ||
①用惰性电极电解饱和食盐水的化学方程式为
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
.
| ||
②如图所示原电池放电时,电池中的Na+向
右槽
右槽
(填“左槽”或“右槽”)移动.左槽中发生的电极反应式为2S22--2e-=S42-
2S22--2e-=S42-
.③该原电池工作一段时间后,测得左槽中Na+物质的量由a mol变为b mol,则电解池中b电极上得到的气体在标准状况下的体积为
11.2(a-b)
11.2(a-b)
L(不考虑气体的损失).全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示:
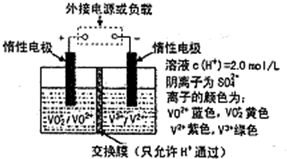
下列说法错误的是( )

下列说法错误的是( )
A、当左槽溶液逐渐由黄变蓝,其电极反应式为VO
| ||
| B、充电时若转移的电子数为3.01×1023,则左槽溶液中行n(H+)最终的变化量为1mol | ||
| C、放电过程中,氢离子的作用之一是参与正极反应 | ||
| D、充电过程中,右槽溶液颜色逐渐由绿色变为紫色 |
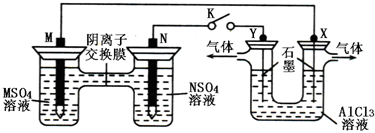 在下列装置中,MSO4和NSO4是两种常见金属的易溶盐.当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是( )
在下列装置中,MSO4和NSO4是两种常见金属的易溶盐.当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是( )