摘要:丰6.下列叙述中.正确的是 A.二氧化硅和干冰晶体熔化时所克服的作用力类型相同 B.分子晶体中一定含有共价键.离子晶体中一定含有离子键 C.离子晶体都是强电解质 D.检验淀粉是否已经全部水解时.可取少量样品.向其中加入银氨溶液.水浴加热.若能生成银镜说明淀粉已经全部水解
网址:http://m.1010jiajiao.com/timu3_id_378022[举报]
(山东省章丘市2007—2008学年上学期期中考试,化学,6)下列叙述中正确的是
A.使用托盘天平称量药品时,5g以下用游码
B.用干燥的pH试纸检测某溶液的酸碱性
C.给盛有药品的试管加热时,管口应略高于管底
D.向滴有酚酞的NaOH溶液中通入Cl2,红色消失,说明HClO具有漂白性
查看习题详情和答案>>一定温度下,在固定体积的密闭容器中发生可逆反应 A(s)+2B(g)?2C(g),下列叙述中是反应达到平衡的标志的是( )
(1)v正(A)=2v逆(C);
(2)单位时间生成amol A,同时生成2amol B;
(3)A、B、C的浓度不再变化;
(4)混合气体的平均摩尔质量不再变化;
(5)混合气体的总压强不再变化;
(6)A、B、C的分子数目比为1:3:2.
(1)v正(A)=2v逆(C);
(2)单位时间生成amol A,同时生成2amol B;
(3)A、B、C的浓度不再变化;
(4)混合气体的平均摩尔质量不再变化;
(5)混合气体的总压强不再变化;
(6)A、B、C的分子数目比为1:3:2.
查看习题详情和答案>>
下列叙述中正确的是( )
| A、用带玻璃塞的棕色试剂瓶存放浓硝酸 | B、将标况下22.4LHCl溶于1L水中可配制1mol?L-1的盐酸 | C、31g白磷(P4为正四面体结构)所含共价键数为6.02×1023 | D、向某溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀,则该溶液中一定含有SO42- |
下列叙述中正确的有( )个
①燃烧热是指1mol可燃物完全燃烧生成氧化物时所释放的能量
②某反应的△H=+100kJ/mol,可知该反应的正反应活化能比逆反应活化能大100kJ/mol
③碳酸铵在室温条件下能自发分解产生氨气,是因为生成了气体,体系的熵增大
④强电解质水溶液的导电能力一定比弱电解质水溶液的导电能力强
⑤Mg比Al活泼,在Mg和Al形成的原电池中,Mg必定做负极
⑥轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阳极的阴极保护法进行保护.
①燃烧热是指1mol可燃物完全燃烧生成氧化物时所释放的能量
②某反应的△H=+100kJ/mol,可知该反应的正反应活化能比逆反应活化能大100kJ/mol
③碳酸铵在室温条件下能自发分解产生氨气,是因为生成了气体,体系的熵增大
④强电解质水溶液的导电能力一定比弱电解质水溶液的导电能力强
⑤Mg比Al活泼,在Mg和Al形成的原电池中,Mg必定做负极
⑥轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阳极的阴极保护法进行保护.
| A、3 | B、4 | C、5 | D、6 |
(2013?济南二模)硫元素的化合物在生产、生活中有着广泛的应用.
(1)400℃,1.01×105Pa下,容积为1.0L的密闭容器中充入0.5molSO2,(g)和0.3molO2 (g),发生2SO2(g)+O2(g)?2SO3(g)△H=-198kJ?mol-1反应中n(SO3)和n(O2)随时间变化的关系如图1所示.反应的平衡常数K=
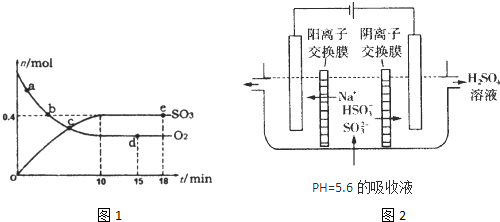
A.a点时刻的正反应速率比b点时刻的大
B.c点时刻反应达到平衡状态
C.d点和e点时刻的c(O2)相同
D.若500℃,1.01×105Pa下,反应达到平衡时,n( SO3)比图中e点时刻的值大
(2)用NaOH溶液吸收工业废气中的SO2,当吸收液失去吸收能力时,25℃时测得溶液的pH=5.6,溶液中Na+,H+,SHO3-,SO32-离子的浓度由大到小的顺序是
(3)可通过电解法使(2)中的吸收液再生而循环利用(电极均为石墨电极),其工作示意图如图2:HSO3-在阳极室反应的电极反应式为
查看习题详情和答案>>
(1)400℃,1.01×105Pa下,容积为1.0L的密闭容器中充入0.5molSO2,(g)和0.3molO2 (g),发生2SO2(g)+O2(g)?2SO3(g)△H=-198kJ?mol-1反应中n(SO3)和n(O2)随时间变化的关系如图1所示.反应的平衡常数K=
160
160
;0到10min内用SO2:表示的平均反应速率0.04mol/(L?min)
0.04mol/(L?min)
.更具图1中信息,判断下列叙述中正确的是AC
AC
(填序号).
A.a点时刻的正反应速率比b点时刻的大
B.c点时刻反应达到平衡状态
C.d点和e点时刻的c(O2)相同
D.若500℃,1.01×105Pa下,反应达到平衡时,n( SO3)比图中e点时刻的值大
(2)用NaOH溶液吸收工业废气中的SO2,当吸收液失去吸收能力时,25℃时测得溶液的pH=5.6,溶液中Na+,H+,SHO3-,SO32-离子的浓度由大到小的顺序是
c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
(3)可通过电解法使(2)中的吸收液再生而循环利用(电极均为石墨电极),其工作示意图如图2:HSO3-在阳极室反应的电极反应式为
HSO3-+H2O-2e-=SO42-+3H+
HSO3-+H2O-2e-=SO42-+3H+
.阴极室的产物H2、NaOH
H2、NaOH
.