网址:http://m.1010jiajiao.com/timu3_id_377893[举报]
某混合物7.8g,与足量盐酸反应后,放出8.96L标准状况下的气体,此混合物由正二价和正三价两种金属混合而成,正二价金属的式量是正三价金属式量的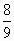 倍,且混合物中两种原子个数比为1∶2.
倍,且混合物中两种原子个数比为1∶2.
(1)写出这两种金属的式量和元素符号.
(2)已知二价金属原子核内的质子数与中子数相等,三价金属原子核内的质子数比中子数少1个,试推测这两种金属元素在周期表中的位置.
查看习题详情和答案>>(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式
(2)若将(1)中的反应设计成原电池,请在右边方框内画出原电池的装置图,标出正、负极,并写出电极反应式.
正极反应
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
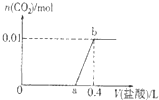 向NaOH和Na2CO3混合溶液中滴加0.1mol?L-1稀盐酸,CO2的生成量与加入盐
向NaOH和Na2CO3混合溶液中滴加0.1mol?L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是( )
| A、在0-a范围内,只发生中和反应 | ||
B、ab段发生反应的离子方程式为:CO
| ||
| C、a=0.3 | ||
| D、原混合溶液中NaOH与Na2CO3的物质的量之比为1:2 |
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式_______________________________。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应___________________ 负极反应________________________
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤__________________________。
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时约pH |
Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢。但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式__________________________
劣质不锈钢腐蚀的实验现象_________________________________
 向盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液至过量,生成沉淀Al(OH)3的量随着加入NaOH溶液体积的变化关系如图所示,下列说法正确的是( )
向盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液至过量,生成沉淀Al(OH)3的量随着加入NaOH溶液体积的变化关系如图所示,下列说法正确的是( )