摘要:3.以上知识是高考必考内容.常以选择题.简答题和推断填空题的形式出现. [典型例题] [例1]例1在人体所需的16种微量元素中有一种被称为生命元素的R 元素.对延长人类寿命起着重要的作用.已知R元素的原子有四个电子层.其最高价氧化物分子式为RO3.则R元素的名称 A. 硫 B. 砷 C. 硒 D. 硅 [备选1]:周期表前20号元素中.某两种元素的原子序数相差1.它们形成化合物时.原子数之比为1﹕2.写出这些化合物的化学式 [备选2]:X.Y.Z为短周期元素.这些元素原子的最外层电子数分别为1.4.6.则由这三种元素组成的化学式不可能是 A. XYZ B.X2YZ C.X2YZ2 D.X3YZ3 [例2]下列有关物质的性质比较正确的是 (1) 同主族元素的单质从上到下.非金属性减弱.熔点增高 (2) 元素的最高正化合价在数值上等于它所在的族序数 (3) 同周期主族元素的原子半径越小.越难失去电子 (4) 元素的非金属性越强.它的气态氢化物水溶液的酸性越强 (5) 还原性:S2->Se2->Br->Cl- (6) 酸性:HClO4>H2SO4>H3PO4>H2SiO3 A. C. [备选1]下表是X.Y.Z三种元素的氢化物的某些性质: 元素 熔点/℃ 沸点/℃ 与水的反应 导电性 X -283 -162 不反应 不导电 Y -102 19 放热反应.形成酸性溶液 不导电 Z 680 / 剧烈反应.生成H2.并形成碱性溶液 导电 若X.Y.Z这三种元素属于周期表中的同一周期.则它们的原子序数递增的顺序是 A. X.Y.Z B. Z.X.Y C. Y.X.Z D. Z.Y.X [例3] 下表是元素周期表的一部分.表中所列的字母分别表示一种化学元素. b h j a c f i l m e g d k (1)下列 组元素可能都是电的良导体. ①a.c.h ②b.g.k ③c.h.l ④d.e.f (2)如果给核外电子足够的能量.这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
网址:http://m.1010jiajiao.com/timu3_id_377809[举报]
工业含铬(Cr)废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀.废水pH与Cr2O72-转化为Cr3+的关系如图1,实验室模拟工业电解法处理含铬废水的装置如图2:

请根据以上知识回答下列问题:
(1)含铬废水预处理的方法是
(2)在图2中连接铁棒的一极是电源的
(3)实验中除能观察到废水颜色发生变化外,还能观察到的现象是
表一:
(4)当废水颜色不再发生明显变化时,切断电源,取出电极,再调节电解液的pH至8左右.调节pH的目的是
(5)含铬废水国家排放标准为
含量≤0.1000mg/L.取上述电解后的废水200.00mL,调节pH=1后置于锥形瓶中,用浓度为0.0001mol/L的KI溶液滴定,至滴定终点时,用去KI溶液9.00mL.已知酸性条件下,I-被Cr2O72-氧化的产物为I2.用计算所得数据说明上述电解法处理后的废水是否符合国家排放标准
查看习题详情和答案>>

请根据以上知识回答下列问题:
(1)含铬废水预处理的方法是
调节pH为1左右
调节pH为1左右
.(2)在图2中连接铁棒的一极是电源的
正
正
极.(3)实验中除能观察到废水颜色发生变化外,还能观察到的现象是
阴极区产生沉淀
阴极区产生沉淀
.表一:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cr(OH)3 | Al(OH)3 |
| 开始沉淀 | 2.7 | 7.5 | 4.3 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 5.6 | 5.2 |
使溶液中的Fe3+、Cr3+全部转化为氢氧化物沉淀
使溶液中的Fe3+、Cr3+全部转化为氢氧化物沉淀
.(5)含铬废水国家排放标准为
| +6 |
| Cr |
符合
符合
.硫是煤中的有害成分.艾士卡法是世界公认的测定煤中硫含量的标准方法.
原理:将煤样与艾氏卡试剂(简称艾氏剂)混合灼烧,煤中的硫全部转化为硫酸盐,然后以BaCl2为沉淀剂使硫酸根离子转化为硫酸钡沉淀.根据硫酸钡的质量计算煤样中硫的含量.艾氏剂是质量比为2:1的轻质MgO与无水Na2CO3的混合物.
实验步骤:
①称取粉碎的干燥煤样1.00g和艾氏剂2g置于30mL的瓷坩埚中,充分混匀,再用1g艾氏剂覆盖.高温加热1~2h.
②取出坩埚,冷却到室温,将灼烧物放入烧杯中,用热蒸馏水冲洗坩埚内壁,将冲洗液加入烧杯中,再加入100~150mL 煮沸的蒸馏水,充分搅拌.
③过滤,用热蒸馏水冲洗烧杯3次,冲洗液加入过滤器.再用热蒸馏水清洗残渣至少10次.
④在上述滤液中滴加盐酸溶液,使溶液呈微酸性.将溶液加热至沸腾,在不断搅拌下滴入BaCl2溶液l0mL,在近沸腾状况下保持2h.
⑤将溶液与其中沉淀放置过夜后,经过滤、洗涤、干燥后称量,得沉淀m1g.
⑥艾氏剂应进行空白实验(实验除不加煤样外,全部按步骤①~⑤进行,目的是排除其他含硫物质的干扰),得到沉淀质量为m2g.
根据以上知识回答下列问题:
(1)写出煤中燃烧产生的二氧化硫被艾氏剂中的Na2CO3吸收生成硫酸盐的化学方程式 .
(2)如果步骤③中残渣清洗不充分,实验结果将 .如果步骤④中用硫酸代替盐酸,实验结果将 (均填“偏大”、“偏小”或“无影响”)
(3)步骤④在滤液中滴加盐酸使溶液呈微酸性的目的是 .
(4)如何用实验证明步骤⑤中的沉淀已洗净? .
(5)用上述实验数据(包括字母)表示出该煤样中硫元素质量分数 .
查看习题详情和答案>>
原理:将煤样与艾氏卡试剂(简称艾氏剂)混合灼烧,煤中的硫全部转化为硫酸盐,然后以BaCl2为沉淀剂使硫酸根离子转化为硫酸钡沉淀.根据硫酸钡的质量计算煤样中硫的含量.艾氏剂是质量比为2:1的轻质MgO与无水Na2CO3的混合物.
实验步骤:
①称取粉碎的干燥煤样1.00g和艾氏剂2g置于30mL的瓷坩埚中,充分混匀,再用1g艾氏剂覆盖.高温加热1~2h.
②取出坩埚,冷却到室温,将灼烧物放入烧杯中,用热蒸馏水冲洗坩埚内壁,将冲洗液加入烧杯中,再加入100~150mL 煮沸的蒸馏水,充分搅拌.
③过滤,用热蒸馏水冲洗烧杯3次,冲洗液加入过滤器.再用热蒸馏水清洗残渣至少10次.
④在上述滤液中滴加盐酸溶液,使溶液呈微酸性.将溶液加热至沸腾,在不断搅拌下滴入BaCl2溶液l0mL,在近沸腾状况下保持2h.
⑤将溶液与其中沉淀放置过夜后,经过滤、洗涤、干燥后称量,得沉淀m1g.
⑥艾氏剂应进行空白实验(实验除不加煤样外,全部按步骤①~⑤进行,目的是排除其他含硫物质的干扰),得到沉淀质量为m2g.
根据以上知识回答下列问题:
(1)写出煤中燃烧产生的二氧化硫被艾氏剂中的Na2CO3吸收生成硫酸盐的化学方程式
(2)如果步骤③中残渣清洗不充分,实验结果将
(3)步骤④在滤液中滴加盐酸使溶液呈微酸性的目的是
(4)如何用实验证明步骤⑤中的沉淀已洗净?
(5)用上述实验数据(包括字母)表示出该煤样中硫元素质量分数
 金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN-和金属离子的配离子M(CN)nm-的形式存在于水中.测定污水中含氰化合物含量的实验步骤如下:
金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN-和金属离子的配离子M(CN)nm-的形式存在于水中.测定污水中含氰化合物含量的实验步骤如下:①水样预处理:水样中加入磷酸和EDTA,在pH<2的条件下加热蒸馏,蒸出所有的HCN,并用NaOH溶液吸收.
②滴定:将吸收液调节至pH>11,以试银灵作指示剂,用AgNO3标准溶液滴定Ag++2CN-═[Ag(CN)2]-终点时,溶液由黄色变成橙红色.
根据以上知识回答下列问题:
(1)水样预处理的目的是
(2)水样预处理的装置如图,细导管插入吸收液中是为了
(3)蒸馏瓶比吸收液面要高出很多,其目的是
(4)如果用盐酸代替磷酸进行预处理,实验结果将
(5)准确移取某工厂污水100mL,经处理后用浓度为0.01000mol?L-1的硝酸银标准溶液滴定,终点时消耗了21.00mL.此水样中含氰化合物的含量为
稗草烯:α一(2,2,2-三氯乙基)苯乙烯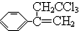 ,它是一种选择性内吸传导性除草剂,主要用于水稻田防除稗草.温度和湿度对药效影响较大,温度高、湿度大时药效发挥快.在同一剂量下,15℃以下只能起抑制作用,25℃以上 3~5 天杂草就枯死.一般情况下对水稻安全,但施药期不当、用量过大、施药不均等也易产生药害.已知:同一碳原子连两个羟基基不稳定(
,它是一种选择性内吸传导性除草剂,主要用于水稻田防除稗草.温度和湿度对药效影响较大,温度高、湿度大时药效发挥快.在同一剂量下,15℃以下只能起抑制作用,25℃以上 3~5 天杂草就枯死.一般情况下对水稻安全,但施药期不当、用量过大、施药不均等也易产生药害.已知:同一碳原子连两个羟基基不稳定(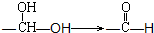 ).下列说法不正确的是( )
).下列说法不正确的是( )
 ,它是一种选择性内吸传导性除草剂,主要用于水稻田防除稗草.温度和湿度对药效影响较大,温度高、湿度大时药效发挥快.在同一剂量下,15℃以下只能起抑制作用,25℃以上 3~5 天杂草就枯死.一般情况下对水稻安全,但施药期不当、用量过大、施药不均等也易产生药害.已知:同一碳原子连两个羟基基不稳定(
,它是一种选择性内吸传导性除草剂,主要用于水稻田防除稗草.温度和湿度对药效影响较大,温度高、湿度大时药效发挥快.在同一剂量下,15℃以下只能起抑制作用,25℃以上 3~5 天杂草就枯死.一般情况下对水稻安全,但施药期不当、用量过大、施药不均等也易产生药害.已知:同一碳原子连两个羟基基不稳定(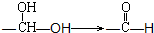 ).下列说法不正确的是( )
).下列说法不正确的是( )
查看习题详情和答案>>
硅酸盐材料是用含硅物质为原料加热制成的,硅酸盐工业包括制水泥、玻璃、陶瓷等。水泥具有水硬性等优点;玻璃具有良好的光学性质和可塑性;陶瓷有抗氧化、抗腐蚀、耐高温等优点。根据以上知识判断下列关于硅酸盐的说法中,合理的有_________________。
①硅酸盐及其制品性质稳定,熔点很高,都难溶于水 ②生产光导纤维的主要原料是玻璃③玻璃是硅酸钠、硅酸钙、二氧化硅的熔合物④制取普通玻璃和普通水泥的原料中均有石灰石 ⑤高岭石Al2(Si2O5)(OH)4可以表示成Al2O3·2SiO2·2H2O,因为硅酸盐是由氧化物组成的 ⑥水泥具有水硬性,故水泥不能进行水下施工 ⑦钢化玻璃和水晶玻璃都是普通玻璃加热软化,然后急速冷却而制成的高强度玻璃
查看习题详情和答案>>