摘要:2.以第3周期为例.掌握同一周期内元素性质(如:原子半径.化合价.单质及化合物性质)的递变规律与原子结构的关系,以ⅠA和ⅦA族为例.掌握同一主族内元素性质递变规律与原子结构的关系.
网址:http://m.1010jiajiao.com/timu3_id_377808[举报]
(2009?安徽模拟)某化学研究性学习小组为探究元素性质的变化规律,设计了如下实验:
(1)甲同学根据同周期元素原子结构的变化规律,预测出同一周期,从左至右元素的金属性逐渐减弱.请你根据实验室常用试剂和仪器帮助甲同学设计实验,简述实验步骤和现象(以第三周期元素为例):
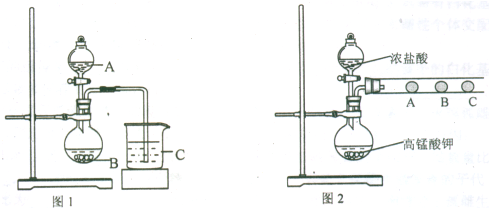
(2)乙同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其能否达到实验目的
(3)丙同学从资料中获悉:元素周期表中处于象硼与硅这样“对角线”位置的某些元素性质相似.预测金属铍应该具有与
(4)丁同学设计了如图2装置验证元素性质递变规律.A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.丁同学可能观察到的现象有

查看习题详情和答案>>
(1)甲同学根据同周期元素原子结构的变化规律,预测出同一周期,从左至右元素的金属性逐渐减弱.请你根据实验室常用试剂和仪器帮助甲同学设计实验,简述实验步骤和现象(以第三周期元素为例):
分别取钠、镁、铝小粒分别与冷水反应,钠剧烈反应,镁和铝无明显现象;另取镁、铝小粒分别与等浓度的盐酸反应,镁比铝反应剧烈
分别取钠、镁、铝小粒分别与冷水反应,钠剧烈反应,镁和铝无明显现象;另取镁、铝小粒分别与等浓度的盐酸反应,镁比铝反应剧烈
.(2)乙同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其能否达到实验目的
能
能
(填“能”或“不能”),设计的理论依据是元素的非金属性越强,其最高价氧化物的水合物酸性越强
元素的非金属性越强,其最高价氧化物的水合物酸性越强
. 但也有同学根据硝酸具有挥发性,认为乙同学的实验装置存在不足,请你帮助该同学提出修改意见在两导管之间连接一个装有饱和碳酸钠的洗气瓶
在两导管之间连接一个装有饱和碳酸钠的洗气瓶
.(3)丙同学从资料中获悉:元素周期表中处于象硼与硅这样“对角线”位置的某些元素性质相似.预测金属铍应该具有与
铝
铝
相似的性质,能证明其预测的实验方案是铍单质分别与酸和强碱反应,看反应现象
铍单质分别与酸和强碱反应,看反应现象
.(4)丁同学设计了如图2装置验证元素性质递变规律.A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.丁同学可能观察到的现象有
A:白色变成黄色或橙黄色;B:变蓝色;C:红纸褪色
A:白色变成黄色或橙黄色;B:变蓝色;C:红纸褪色
. 从环保角度考虑,该装置有明显不足,请指出并提出改进建议尾气排入空气污染环境,应在试管口处放一团浸有氢氧化钠溶液的棉花
尾气排入空气污染环境,应在试管口处放一团浸有氢氧化钠溶液的棉花
.
某化学研究性学习小组为探究元素性质的变化规律,设计了如下实验:
(1)甲同学根据同周期元素原子结构的变化规律,预测出同一周期,从左至右元素的金属性逐渐减弱.请你根据实验室常用试剂和仪器帮助甲同学设计实验,简述实验步骤和现象(以第三周期元素为例):______.
(2)乙同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其能否达到实验目的______(填“能”或“不能”),设计的理论依据是______. 但也有同学根据硝酸具有挥发性,认为乙同学的实验装置存在不足,请你帮助该同学提出修改意见______.
(3)丙同学从资料中获悉:元素周期表中处于象硼与硅这样“对角线”位置的某些元素性质相似.预测金属铍应该具有与______相似的性质,能证明其预测的实验方案是______.
(4)丁同学设计了如图2装置验证元素性质递变规律.A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.丁同学可能观察到的现象有______. 从环保角度考虑,该装置有明显不足,请指出并提出改进建议______.

查看习题详情和答案>>
(1)甲同学根据同周期元素原子结构的变化规律,预测出同一周期,从左至右元素的金属性逐渐减弱.请你根据实验室常用试剂和仪器帮助甲同学设计实验,简述实验步骤和现象(以第三周期元素为例):______.
(2)乙同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其能否达到实验目的______(填“能”或“不能”),设计的理论依据是______. 但也有同学根据硝酸具有挥发性,认为乙同学的实验装置存在不足,请你帮助该同学提出修改意见______.
(3)丙同学从资料中获悉:元素周期表中处于象硼与硅这样“对角线”位置的某些元素性质相似.预测金属铍应该具有与______相似的性质,能证明其预测的实验方案是______.
(4)丁同学设计了如图2装置验证元素性质递变规律.A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.丁同学可能观察到的现象有______. 从环保角度考虑,该装置有明显不足,请指出并提出改进建议______.

查看习题详情和答案>>
某化学研究性学习小组为探究元素性质的变化规律,设计了如下实验:
(1)甲同学根据同周期元素原子结构的变化规律,预测出同一周期,从左至右元素的金属性逐渐减弱.请你根据实验室常用试剂和仪器帮助甲同学设计实验,简述实验步骤和现象(以第三周期元素为例):______.
(2)乙同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其能否达到实验目的______(填“能”或“不能”),设计的理论依据是______. 但也有同学根据硝酸具有挥发性,认为乙同学的实验装置存在不足,请你帮助该同学提出修改意见______.
(3)丙同学从资料中获悉:元素周期表中处于象硼与硅这样“对角线”位置的某些元素性质相似.预测金属铍应该具有与______相似的性质,能证明其预测的实验方案是______.
(4)丁同学设计了如图2装置验证元素性质递变规律.A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.丁同学可能观察到的现象有______. 从环保角度考虑,该装置有明显不足,请指出并提出改进建议______.
查看习题详情和答案>>
(1)甲同学根据同周期元素原子结构的变化规律,预测出同一周期,从左至右元素的金属性逐渐减弱.请你根据实验室常用试剂和仪器帮助甲同学设计实验,简述实验步骤和现象(以第三周期元素为例):______.
(2)乙同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其能否达到实验目的______(填“能”或“不能”),设计的理论依据是______. 但也有同学根据硝酸具有挥发性,认为乙同学的实验装置存在不足,请你帮助该同学提出修改意见______.
(3)丙同学从资料中获悉:元素周期表中处于象硼与硅这样“对角线”位置的某些元素性质相似.预测金属铍应该具有与______相似的性质,能证明其预测的实验方案是______.
(4)丁同学设计了如图2装置验证元素性质递变规律.A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.丁同学可能观察到的现象有______. 从环保角度考虑,该装置有明显不足,请指出并提出改进建议______.

利用化石燃料开采、加工过程产生的H2S废气制取氢气,既价廉又环保.

(1)工业上可用组成为K2O?M2O3?2RO2?nH2O的无机材料纯化制取的氢气
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为
②常温下,不能与M单质发生反应的是 (填序号)
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气来的方法有多种
①高温热分解法
已知:H2S(g)?H2(g)+1/2S2(g)
在恒温密闭容器中,控制不同温度进行H2S分解实验.以H2S起始浓度均为cmol?L-1测定H2S的转化率,结果见右图.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.据图计算985℃时H2S按上述反应分解的平衡常数K= ;说明随温度的升高,曲线b向曲线a逼近的原因:
②电化学法
该法制氢过程的示意图如右.反应池中反应物的流向采用气、液逆流方式,其目的是 ;反应池中发生反应的化学方程式为 .反应后的溶液进入电解池,电解总反应的离子方程式为 .
查看习题详情和答案>>

(1)工业上可用组成为K2O?M2O3?2RO2?nH2O的无机材料纯化制取的氢气
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为
②常温下,不能与M单质发生反应的是
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气来的方法有多种
①高温热分解法
已知:H2S(g)?H2(g)+1/2S2(g)
在恒温密闭容器中,控制不同温度进行H2S分解实验.以H2S起始浓度均为cmol?L-1测定H2S的转化率,结果见右图.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.据图计算985℃时H2S按上述反应分解的平衡常数K=
②电化学法
该法制氢过程的示意图如右.反应池中反应物的流向采用气、液逆流方式,其目的是
(2011?南开区一模)X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料.用化学用语回答下列问题:
(1)L的元素符号为
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是
(3)Y的最高价氧化物的电子式为
 .原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是
.原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是
(4)Z、W各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是
(6)碘是人体必需的微量元素之一,有“智力元素”之称.我国从1989年开始,逐步以KIO3取代KI加工碘盐.已知在酸性溶液中可发生反应:IO3-+5I-+6H+═3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在IO3-.可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖.你认为进行上述实验时必须使用的物质是
查看习题详情和答案>>
(1)L的元素符号为
Si
Si
;M在元素周期表中的位置为第3周期第ⅦA族
第3周期第ⅦA族
.(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是
H2SiO3<H2CO3<HClO4
H2SiO3<H2CO3<HClO4
.(3)Y的最高价氧化物的电子式为


2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
(4)Z、W各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为
Al(OH)3+OH-═AlO2-+2H2O
Al(OH)3+OH-═AlO2-+2H2O
.(5)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是
Si3N4
Si3N4
.(6)碘是人体必需的微量元素之一,有“智力元素”之称.我国从1989年开始,逐步以KIO3取代KI加工碘盐.已知在酸性溶液中可发生反应:IO3-+5I-+6H+═3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在IO3-.可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖.你认为进行上述实验时必须使用的物质是
③⑤
③⑤
(填序号).