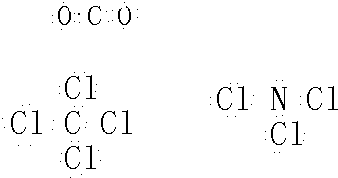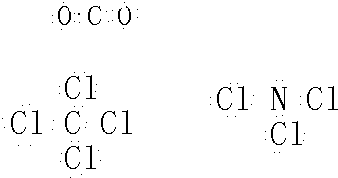摘要:用实验确定某酸HA是弱电解质.两同学的方案是: 甲:① 称取一定质量的HA配制0.lmol/L的溶液100mL, ② 用pH试纸测出该溶液的pH值.即可证明HA是弱电解质. 乙:① 用已知物质的量浓度的HA溶液.盐酸.分别配制pH=l的两种酸溶液各100mL, ② 分别取这两种溶液各10mL.加水稀释为100mL, ③ 各取相同体积的两种稀释液装入两个试管.同时加入纯度相同的锌粒.观察现 象.即可证明HA是弱电解质. (1)在两个方案的第①步中.都要用到的定量仪器是 (2)甲方案中.说明HA是弱电解质的理由是测得溶液的pH 1 乙方案中.说明HA是弱电解质的现象是 (a)装HCl溶液的试管中放出H2的速率快, (b)装HA溶液的试管中放出H2的速率快, (c)两个试管中产生气体速率一样快. (3)请你评价:乙方案中难以实现之处和不妥之处 . (4)请你再提出一个合理而比较容易进行的方案.作简明扼要表述. (1)100mL容量瓶 配制pH=l的HA溶液难以实现 不妥之处在于加入的锌粒难以做到表面积相同 (4)配制NaA溶液.测其pH值>7即证明HA是弱电解质
网址:http://m.1010jiajiao.com/timu3_id_377565[举报]
《化学与技术》模块
电石浆是氯碱工业中的一种废弃物,其大致组成如下表所示:
用电石浆可生产无水CaCl2,某化工厂设计了以下工艺流程:
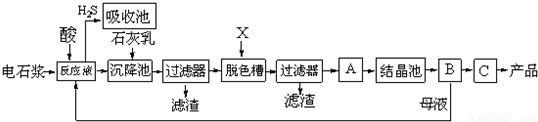
已知氯化钙晶体化学式是:CaCl2?6H2O,H2S是一种酸性气体,具有还原性.
(1)反应器中加入的酸应选用______.
(2)脱色槽中应加入的物质X是______;设备A的作用是______;设备B的名称是______;设备C的作用是______.
(3)为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是______.
A.水 B.浓硫酸 C.石灰乳 D.硝酸
(4)将设备B中产生的母液重新引入反应器的目的是______.
查看习题详情和答案>>
电石浆是氯碱工业中的一种废弃物,其大致组成如下表所示:
| 成分 | CaO | SiO2 | Al2O3 | Fe2O3 | MgO | CaS | 其它不溶于酸的物质 |
| 质量分数(%) | 65~66 | 3.5~5.0 | 1.5~3.5 | 0.2~0.8 | 0.2~1.1 | 1.0~1.8 | 23~26 |

已知氯化钙晶体化学式是:CaCl2?6H2O,H2S是一种酸性气体,具有还原性.
(1)反应器中加入的酸应选用______.
(2)脱色槽中应加入的物质X是______;设备A的作用是______;设备B的名称是______;设备C的作用是______.
(3)为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是______.
A.水 B.浓硫酸 C.石灰乳 D.硝酸
(4)将设备B中产生的母液重新引入反应器的目的是______.
查看习题详情和答案>>
《化学与技术》模块
电石浆是氯碱工业中的一种废弃物,其大致组成如下表所示:
| 成分 | CaO | SiO2 | Al2O3 | Fe2O3 | MgO | CaS | 其它不溶于酸的物质 |
| 质量分数(%) | 65~66 | 3.5~5.0 | 1.5~3.5 | 0.2~0.8 | 0.2~1.1 | 1.0~1.8 | 23~26 |
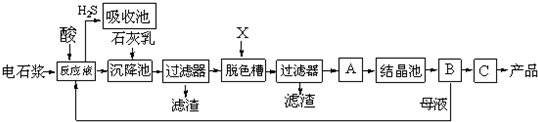
已知氯化钙晶体化学式是:CaCl2?6H2O,H2S是一种酸性气体,具有还原性.
(1)反应器中加入的酸应选用______.
(2)脱色槽中应加入的物质X是______;设备A的作用是______;设备B的名称是______;设备C的作用是______.
(3)为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是______.
A.水 B.浓硫酸 C.石灰乳 D.硝酸
(4)将设备B中产生的母液重新引入反应器的目的是______. 查看习题详情和答案>>
(2010?石家庄模拟)回答下列有关周期表的问题:
(1)在图所示元素周期表中请用实线(黑色中性笔)画出主族元素的边界.
(2)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A.写出A的电子式
 .
.
(3)在所有的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式
(4)金属元素丙形成的某化合物的溶液常用于检验CO2,则元素丙的简单离子与元素甲的简单离子的半径大小关系是
(5)丁与戊分别是第三周期中简单离子半径最小和最大的金属元素,写出丁元素的单质与戊最高价氧化物对应的水化物溶液反应的离子方程式
查看习题详情和答案>>
(1)在图所示元素周期表中请用实线(黑色中性笔)画出主族元素的边界.

(2)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A.写出A的电子式


(3)在所有的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式
2F2+2H2O═4HF+O2
2F2+2H2O═4HF+O2
(4)金属元素丙形成的某化合物的溶液常用于检验CO2,则元素丙的简单离子与元素甲的简单离子的半径大小关系是
r(Ca2+)<r(Cl-)
r(Ca2+)<r(Cl-)
(用离子符号表示)(5)丁与戊分别是第三周期中简单离子半径最小和最大的金属元素,写出丁元素的单质与戊最高价氧化物对应的水化物溶液反应的离子方程式
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
.(物质结构)下表中实线是元素周期表的部分边界,其中上边界并未用实线标出.
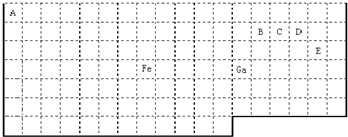
根据信息回答下列问题:
(1)周期表中基态Ga原子的最外层电子排布式为
(2)Fe元素位于周期表的
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有
(4)根据VSEPR理论预测ED4-离子的空间构型为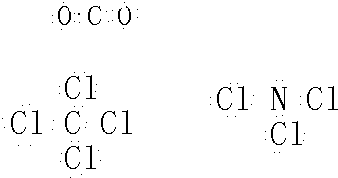
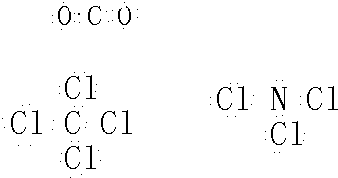 (写3种)
(写3种)
查看习题详情和答案>>

根据信息回答下列问题:
(1)周期表中基态Ga原子的最外层电子排布式为
4s24p1
4s24p1
.(2)Fe元素位于周期表的
d
d
分区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为0
0
;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征.与CO分子互为等电子体的分子和离子分别为N2
N2
和CN-
CN-
(填化学式).(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有
CH4CH3OH
CH4CH3OH
.(4)根据VSEPR理论预测ED4-离子的空间构型为
正四面体
正四面体
型.B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的电子式为: