网址:http://m.1010jiajiao.com/timu3_id_377390[举报]
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为______(填序号).
A.加入一定量M B.降低反应温度 C.升高反应温度
D.缩小容器体积 E.加入催化剂 F.分离出一定量P
②在某温度下起始反应物的浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为______;若保持温度不变,起始反应物的浓度改为:c(M)=4mol?L-1,c(N)=a mol?L-1,达到平衡后,c(P)=2mol?L-1,则a=______mol?L-1.
(2)盖斯定律在生产和科学研究中有很重要的意义.试根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ?mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:______.
(3)一定温度下,向Na2CO3溶液中加入BaCl2和K2SO4,当两种沉淀共存时,c(CO32-):c(SO42-)=______.
[已知Ksp(Ba SO4)=1.3×10-10,Ksp(BaCO3)=2.6×10-9].
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为______(填序号).
A.加入一定量M B.降低反应温度 C.升高反应温度
D.缩小容器体积 E.加入催化剂 F.分离出一定量P
②在某温度下起始反应物的浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为______;若保持温度不变,起始反应物的浓度改为:c(M)=4mol?L-1,c(N)=a mol?L-1,达到平衡后,c(P)=2mol?L-1,则a=______mol?L-1.
(2)盖斯定律在生产和科学研究中有很重要的意义.试根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ?mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:______.
(3)一定温度下,向Na2CO3溶液中加入BaCl2和K2SO4,当两种沉淀共存时,c(CO32-):c(SO42-)=______.
[已知Ksp(Ba SO4)=1.3×10-10,Ksp(BaCO3)=2.6×10-9].
查看习题详情和答案>>
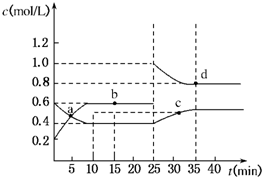 已知NO2与N2O4可相互转化:2NO2(g)?N2O4(g);△H=-24.2kJ/mol,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图所示.下列推理分析合理的是( )
已知NO2与N2O4可相互转化:2NO2(g)?N2O4(g);△H=-24.2kJ/mol,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图所示.下列推理分析合理的是( )| A、反应进行到10 min时,体系吸收的热量为9.68 kJ | B、前10 min内,用v(NO2)表示的反应速率为0.02 mol/(L?min) | C、a、b、c、d四点中v正与v逆均相等 | D、25 min时,导致平衡移动的原因是升温 |
已知:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
(1)450℃时,往一个2L的密闭容器中充入2. 6mol H2和1mol N2, 反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L—1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①此条件下该反应的化学平衡常数K=_______________;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,此时该反应的v(N2)正_______________v(N2)逆(填写“>”、“=”或“<”=)。
②若改变某一条件,达新平衡时n(H2)=1.60mol ,下列说法正确的是_____________。
A.平衡一定正向移动 B.可能是向容器中加入了一定量的H2气体
C.可能是降低了容器的温度 D.可能是缩小了容器的体积
(2)450℃时,在另一密闭容器中进行上述合成氨的反应,各物质的起始浓度和平衡浓度如下表所示:
| N2 | H2 | NH3 | |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0.2 |
| 平衡浓度(mol/L) | a | b | c |
请回答:
①a的取值范围是:_______________.
②请用数学表达式表示下列量之间的关系:
(I)a与b的关系:_______________。(Ⅱ)a、b、c的关系:_______________。
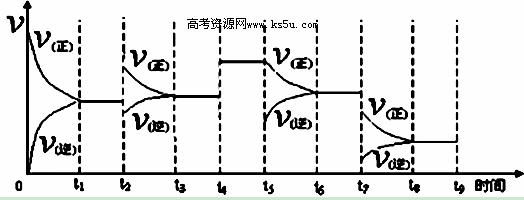
③反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t2﹑t7时刻所对应的实验条件改变分别是:t2 ;t7 。
已知:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
(1)450℃时,往一个2L的密闭容器中充入2. 6mol H2和1mol N2, 反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L—1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①此条件下该反应的化学平衡常数K=_______________;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,此时该反应的v(N2)正_______________v(N2)逆(填写“>”、“=”或“<”=)。
②若改变某一条件,达新平衡时n(H2)=1.60mol ,下列说法正确的是_____________。
A.平衡一定正向移动 B.可能是向容器中加入了一定量的H2气体
C.可能是降低了容器的温度 D.可能是缩小了容器的体积
(2)450℃时,在另一密闭容器中进行上述合成氨的反应,各物质的起始浓度和平衡浓度如下表所示:
| N2 | H2 | NH3 | |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0.2 |
| 平衡浓度(mol/L) | a | b | c |
请回答:
①a的取值范围是:_______________.
②请用数学表达式表示下列量之间的关系:
(I)a与b的关系:_______________。(Ⅱ)a、b、c的关系:_______________。
③反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t2﹑t7时刻所对应的实验条件改变分别是:t2 ;t7 。
