网址:http://m.1010jiajiao.com/timu3_id_377325[举报]
下列离子方程式正确的是
| A.鸡蛋壳浸泡在盐酸中产生气泡:CO32—+2H+===CO2↑+H2O |
| B.小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O |
| C.碘化亚铁溶液中通入少量Cl2:Cl2+2I-===2Cl-+I2 |
| D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4? + 6H+ + 5H2O2= 2Mn2+ + 5O2↑ + 8H2O |
下列离子方程式正确的是
A.鸡蛋壳浸泡在盐酸中产生气泡:CO32—+2H+===CO2↑+H2O
B.小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O
C、碘化亚铁溶液中通入少量Cl2:Cl2+2I-===2Cl-+I2
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4− + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
查看习题详情和答案>>
| A.鸡蛋壳浸泡在盐酸中产生气泡:CO32—+2H+===CO2↑+H2O |
| B.小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O |
| C.碘化亚铁溶液中通入少量Cl2:Cl2+2I-===2Cl-+I2 |
| D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4? + 6H+ + 5H2O2= 2Mn2+ + 5O2↑ + 8H2O |
根据下表提供的材料,下列叙述中,正确的是 ( )
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl2 | ||
| ② | KMnO4 | H2O2 | H2SO4 | O2 | MnSO4 |
| ③ | KClO3 | HCl(浓) | Cl2 | Cl2 | |
| ④ | KMnO4 | HCl(浓) | Cl2 | MnCl2 |
A.表中第①组反应的氧化产物只有FeCl3(实为Fe3+)
B.氧化性比较:KMnO4>Cl2>Fe3+>Br2>Fe2+
C.表中第③组反应的氧化产物与还原产物的质量之比为6:1
D.④的离子方程式配平后,H+的化学计量数应为16
查看习题详情和答案>>某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。
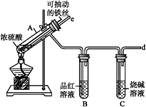
图1 图2
(1)比较两实验装置,图2装置的优点是:
①能更好地吸收有毒气体SO2,防止其污染环境;
② 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而污染环境;二是 。
(3)能说明有SO2气体产生的实验现象是 。
(4)反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
| A.稀HCl溶液 | B.稀H2SO4溶液 | C.KSCN溶液 | D.KMnO4溶液 |
验证Ⅱ:取试样,先滴加少量的 (填试剂序号,下同),振荡,再滴加少量的 ,根据溶液颜色的变化可确定假设Ⅱ是否正确。反应的离子方程式是 ,Fe3++3SCN-
 Fe(SCN)3。
Fe(SCN)3。 验证Ⅲ:步骤1.取试样,滴加少量的 (填试剂序号),溶液的颜色变 色,则试样中含有Fe3+。
步骤2.再取适量的试样滴加到少量的 (填试剂序号),观察到的现象为 ,则试样中含有Fe2+。 查看习题详情和答案>>