摘要:19.A.B.C.D是四种短周期元素.它们的原子序数依次增大.其中A.C及B.D分别是同一主族元素.B.D元素的原子核中质子数之和是A.C两元素原子核中质子数之和的两倍.又知四种元素的单质中有两种气体.两种固体.请回答: ⑴C.D组成的常见化合物.其水溶液呈碱性.原因是 .写出两种均含A.B.C.D四种元素的化合物相互间发生反应.且生成气体的离子方程式 . ⑵D的单质能跟C的最高价氧化物水化物的浓溶液发生氧化还原反应.生成的两种正盐的水溶液均呈碱性.写出该氧化还原反应的离子方程式: . ⑶A.B.D间可形成甲.乙两种微粒.它们均为负一价双原子阴离子且甲有18个电子.乙有10个电子.则甲与乙反应的离子方程式为 . 20右图是元素R的单质及其重要化合物在一定条件下相互转化的关系图(生成物中不含该元素的物质均已略去) 已知.F可用作化肥也可用来作炸药.G可用于建筑工程上的抗冻剂和防腐剂.据此回答下列问题. (1)写出反应①的化学方程式 并指出该反应在现代工业上的重要意义: (2)物质B的分子空间构型为 (3)已知反应②是氧化还原反应.其氧化产物与还原产物的质量比为 (4)写出反应③的离子方程式
网址:http://m.1010jiajiao.com/timu3_id_377242[举报]
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别位于同一主族,A是自然界中原子半径最小的元素,B的最外层电子数是内层电子数的3倍.
(1)写出B的元素符号:B
 ;
;
(2)B与D的氢化物较稳定的是
(3)写出C2B2的电子式
 ;写出实验室制取DB2的化学方程式:
;写出实验室制取DB2的化学方程式:
(4)写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式
查看习题详情和答案>>
(1)写出B的元素符号:B
O
O
,C的原子结构示意图

(2)B与D的氢化物较稳定的是
H2O
H2O
(填化学式),其中所含有的化学键类型为极性键
极性键
;(3)写出C2B2的电子式


Na2SO3+H2SO4═Na2SO4+H2O+SO2↑
Na2SO3+H2SO4═Na2SO4+H2O+SO2↑
(4)写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式
HSO3-+H+=SO2↑+H2O
HSO3-+H+=SO2↑+H2O
. A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体,两种是固体.请回答以下问题:
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体,两种是固体.请回答以下问题:(1)写出由A、B两元素形成的原子个数比为1:1的化合物的化学式
H2O2
H2O2
,此化合物能使酸性KMnO4溶液退色,体现该化合物具有还原性
还原性
性.(2)D元素在元素周期表中的位置
第三周期第ⅥA族
第三周期第ⅥA族
,B和C两元素形成的原子个数比为1:1的化合物中含有的化学键的类型为离子键、共价键
离子键、共价键
.(3)A、B、C、D四种原子半径由大到小为
Na>S>O>H
Na>S>O>H
(填元素符号);四种离子半径由大到小为S2->O2->Na+>H+
S2->O2->Na+>H+
(填离子符号).(4)写出由A、B两元素形成的原子个数比为2:1的化合物与B、C两元素形成的原子个数比为1:1的化合物反应的离子方程式
2Na2O2+2H2O=4Na++4OH-+O2↑
2Na2O2+2H2O=4Na++4OH-+O2↑
.(5)两种物质均由A、B、C、D四种元素组成,写出它们在水溶液中反应的离子方程式
HSO3-+H+=SO2↑+H2O
HSO3-+H+=SO2↑+H2O
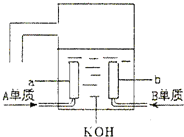
.(6)用A元素的单质与B元素的单质可制成新型的化学电源,已在宇宙飞船中使用.其构造如图所示.两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.则a是
负
负
极,电极反应式为4H2-4e-=4H+
4H2-4e-=4H+
,b是正
正
极,电极反应式为O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体.
请回答下列问题:
(1)B、D在周期表中同处在
 ,下列可以验证B与D两元素原子得电子能力强弱的实验事实是
,下列可以验证B与D两元素原子得电子能力强弱的实验事实是
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的原子的电子层数
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢化合的难易
(2)写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式
(3)A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有l0个电子,则甲与乙反应的离子方程式为
(4)D元素的气态氢化物和其低价氧化物能反应生成D的单质.该反应中氧化产物与还原产物的物质的量之比为
查看习题详情和答案>>
请回答下列问题:
(1)B、D在周期表中同处在
ⅥA
ⅥA
族,B的原子结构示意图是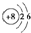
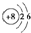
BCD
BCD
(填写编号);A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的原子的电子层数
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢化合的难易
(2)写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式
HSO3-+H+═H2O+SO2↑
HSO3-+H+═H2O+SO2↑
:(3)A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有l0个电子,则甲与乙反应的离子方程式为
HS-+OH-═S2-+H2O
HS-+OH-═S2-+H2O
;(4)D元素的气态氢化物和其低价氧化物能反应生成D的单质.该反应中氧化产物与还原产物的物质的量之比为
2:1
2:1
. A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体,两种是固体.请回答以下问题:
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体,两种是固体.请回答以下问题:(1)写出由A、B两元素形成的原子个数比为1:1的化合物的化学式
H2O2
H2O2
,此化合物能使酸性KMnO4溶液退色,体现该化合物具有还原
还原
性.(2)D的最高价氧化物对应水化物是一种重要的工业产品.下列关于此化合物描述不准确的是
B
B
.A.其浓溶液具有强氧化性,一定条件下能与大多数金属单质反应
B.其浓溶液具有脱水性,所以可用来干燥多种气体
C.其浓溶液和稀溶液都有氧化性,但起氧化作用的元素不同
D.该物质可用铁或者铝容器运输
(3)E、F两种物质均由上述四种元素组成,写出E和F发生反应的离子方程式:
H++HSO3-=SO2↑+H2O
H++HSO3-=SO2↑+H2O
.(4)用A元素的单质与B元素的单质可制成新型的化学电源,已在宇宙飞船中使用.其构造如图所示,两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.则a是
负
负
极,电极反应式为H2+2OH--2e-=2H2O
H2+2OH--2e-=2H2O
,b是正
正
极,电极反应式为O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.