摘要:19.回答下列问题:⑴ 常温下将体积为v1.浓度为c1的一元弱酸与体积为v2.浓度为c2的一元弱碱混合.若v1·c1=v2·c2.混合后的溶液pH<7.则一元弱酸的电离程度 (选填“大于 .“小于 或“等于 )一元弱碱的电离程度, ⑵ 对于一定条件下体积可变的密闭容器中已达平衡的可逆反应: A2C(g),ΔH<0 若其他条件不变.只改变右图中横坐标所表示的物理量.纵坐 标所表示的物理量变化如右图所示: ① 若横坐标表示温度.则纵坐标可以表示 (至 少填两个含义不同的物理量), ② 若横坐标表示压强.则纵坐标 表示平衡混合物的密度.理由是 .
网址:http://m.1010jiajiao.com/timu3_id_377215[举报]
(12分)回答下列问题
(1)CH4、CO2、COCl2和 四种分子中,碳原子为sp2杂化的分子是_______________________________________________。
四种分子中,碳原子为sp2杂化的分子是_______________________________________________。
(2)NH3分子的立体构型是___________形,联氨(N2H4)可视为是NH3分子中的一个氢原子被氨基(-NH2)取代所形成的物质,写出联氨加入足量盐酸反应的化学方程式_________________________________________________________________。
(3)H2O、H2O2、OF2和SCl2四种分子中各原子均达8电子结构的分子是________________。
(4)N2H4与H2O2反应:N2H4(l)+2H2O2=N2(g)+4H2O(g) ,若该反应中有4 mol N—H键断裂,则形成 键有_______mol和形成
键有_______mol和形成 键有_______mol。
键有_______mol。
(5)H2O熔沸点都比H2S高,其原因是___________________________________________。
两种有机物A、B的分子式均为C11H12O5,均能发生如下变化.
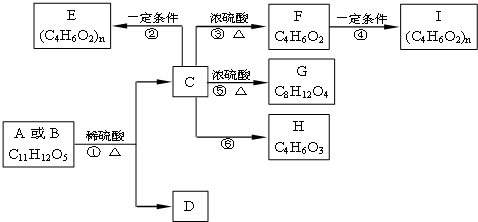
已知:①A、B、C、D均能与NaHCO3反应;
②只有A、D能与FeCl3溶液发生显色反应,且苯环上的一溴代物只有两种;
③F能使溴水褪色且不含有甲基;
④H能发生银镜反应
根据题意回答下列问题:
(1)写出F的结构简式 ;D的含氧官能团有(写名称) .
(2)反应③的反应类型是 ;反应⑥的条件是 .
(3)写出反应②的化学方程式 .
(4)写出B与足量NaOH溶液反应的化学方程式: .
(5)下列关于A~I的说法中错误的是 (选填编号).
a.A与B、E与I均互为同分异构体
b.D在一定条件下也可以反应形成高聚物
c.G具有8元环状结构
d.等质量的A与B分别与足量NaOH溶液反应,消耗等量的NaOH
(6)D的同分异构体有很多,同时符合下列要求的同分异构体有 种.
①苯环上的一卤代物有2种 ②与FeCl3溶液发生显色反应 ③发生银镜反应.
查看习题详情和答案>>

已知:①A、B、C、D均能与NaHCO3反应;
②只有A、D能与FeCl3溶液发生显色反应,且苯环上的一溴代物只有两种;
③F能使溴水褪色且不含有甲基;
④H能发生银镜反应
根据题意回答下列问题:
(1)写出F的结构简式
(2)反应③的反应类型是
(3)写出反应②的化学方程式
(4)写出B与足量NaOH溶液反应的化学方程式:
(5)下列关于A~I的说法中错误的是
a.A与B、E与I均互为同分异构体
b.D在一定条件下也可以反应形成高聚物
c.G具有8元环状结构
d.等质量的A与B分别与足量NaOH溶液反应,消耗等量的NaOH
(6)D的同分异构体有很多,同时符合下列要求的同分异构体有
①苯环上的一卤代物有2种 ②与FeCl3溶液发生显色反应 ③发生银镜反应.
(2012?顺义区二模)有机物A是合成高分子树脂( )和某合成鞣剂(
)和某合成鞣剂(  )的原料之一.相关的合成路线如下图所示(某些生成物已略去):
)的原料之一.相关的合成路线如下图所示(某些生成物已略去):

已知:Ⅰ. (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
Ⅱ.

请回答下列问题:
(1)经质谱测定,有机物A的相对分子质量为164,燃烧8.2g有机物A,生成标准状况下11.2L CO2和5.4g H2O.则A的分子式是.
(2)步骤Ⅰ的目的是
(3)将有机物E溶液滴到饱和溴水中,有大量白色沉淀生成.E的含氧官能团的名称是.H→合成鞣剂的反应类型是
(4)B→D的化学方程式是
 .
.
(5)F→高分子树脂的化学方程式是
 .
.
(6)F的同分异构体X具有如下特点:①与F具有相同的官能团;②苯环上有两个取代基;③1mol X 最多消耗Na、NaOH、NaHCO3的物质的量分别为3、2、1.且X有如下转化关系:

香豆素的结构简式为 ,X的结构简式为
,X的结构简式为
 .由X生成香豆酸的化学方程式是
.由X生成香豆酸的化学方程式是
 .
.
查看习题详情和答案>>
 )和某合成鞣剂(
)和某合成鞣剂(  )的原料之一.相关的合成路线如下图所示(某些生成物已略去):
)的原料之一.相关的合成路线如下图所示(某些生成物已略去):
已知:Ⅰ.
 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)Ⅱ.

请回答下列问题:
(1)经质谱测定,有机物A的相对分子质量为164,燃烧8.2g有机物A,生成标准状况下11.2L CO2和5.4g H2O.则A的分子式是.
(2)步骤Ⅰ的目的是
保护酚羟基
保护酚羟基
;(3)将有机物E溶液滴到饱和溴水中,有大量白色沉淀生成.E的含氧官能团的名称是.H→合成鞣剂的反应类型是
缩聚反应
缩聚反应
.(4)B→D的化学方程式是


(5)F→高分子树脂的化学方程式是


(6)F的同分异构体X具有如下特点:①与F具有相同的官能团;②苯环上有两个取代基;③1mol X 最多消耗Na、NaOH、NaHCO3的物质的量分别为3、2、1.且X有如下转化关系:

香豆素的结构简式为
 ,X的结构简式为
,X的结构简式为



根据中和热测定的实验回答下列问题:
(1)环形搅拌棒不用金属制的原因是
(2)数据处理时所作的近似处理包括
(3)用同一温度计测完盐酸的温度后再测氢氧化钠溶液温度前需进行的操作是:
(4)装置中大、小烧杯间填满碎泡沫塑料(或碎纸条)作用是
(5)已知水的比热容为4.18J/(g?℃),稀盐酸和稀氢氧化钠溶液的浓度分别为c1、c2mol/L,用量均为VmL,混合前溶液的平均温度为t1,混合溶液的最高温度为t2,则中和热△H=
查看习题详情和答案>>
(1)环形搅拌棒不用金属制的原因是
金属易传热,会增加热量损失;
金属易传热,会增加热量损失;
;(2)数据处理时所作的近似处理包括
c(稀溶液)≈c(水)
c(稀溶液)≈c(水)
ρ(稀溶液)≈ρ(水)
ρ(稀溶液)≈ρ(水)
(填两项即可);(3)用同一温度计测完盐酸的温度后再测氢氧化钠溶液温度前需进行的操作是:
将温度计上的酸用水冲洗干净
将温度计上的酸用水冲洗干净
;(4)装置中大、小烧杯间填满碎泡沫塑料(或碎纸条)作用是
减小热量损失
减小热量损失
;(5)已知水的比热容为4.18J/(g?℃),稀盐酸和稀氢氧化钠溶液的浓度分别为c1、c2mol/L,用量均为VmL,混合前溶液的平均温度为t1,混合溶液的最高温度为t2,则中和热△H=
-
| 8.36(t2-t1) |
| c1 |
-
kJ/mol(请写出简化的代数式,否则不给分).| 8.36(t2-t1) |
| c1 |
回收的废旧锌锰于电池经过处理后得到锰粉(含MnO2、Mn(OH)2、Fe、乙炔和黑炭等),由锰粉制取MnO2的步骤如图所示.
根据上图所示步骤并参考表格数据,回答下列问题.
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等.MnO2与浓盐酸反应的离子方程式: .
(2)酸浸时,浸出时间对锰浸出率的影响如下图所示,工业采用的是浸取60min,其可能原因是 .

(3)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是 .
(4)过滤I所得滤液经氧化后,需加入NaOH溶液调节pH约为5.1,其目的是 .
(5)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为 .
(6)工业上利用KOH和MnO2为原料制取KMnO4.主要生产过程分两步进行:
第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌以制取K2MnO4;第二步为电解K2MnO4的浓溶液制取KMnO4.
①第一步反应的化学方程式为 .
②电解K2MnO4的浓溶液时,电解池中阴极的实验现象为 .
查看习题详情和答案>>

根据上图所示步骤并参考表格数据,回答下列问题.
| 物 质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
(2)酸浸时,浸出时间对锰浸出率的影响如下图所示,工业采用的是浸取60min,其可能原因是

(3)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是
(4)过滤I所得滤液经氧化后,需加入NaOH溶液调节pH约为5.1,其目的是
(5)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为
(6)工业上利用KOH和MnO2为原料制取KMnO4.主要生产过程分两步进行:
第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌以制取K2MnO4;第二步为电解K2MnO4的浓溶液制取KMnO4.
①第一步反应的化学方程式为
②电解K2MnO4的浓溶液时,电解池中阴极的实验现象为