网址:http://m.1010jiajiao.com/timu3_id_377142[举报]
Ⅰ.(4分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品 是 。
(2)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
(3)如果反应前后的温度差是(t2-t1),盐酸、氢氧化钠溶液的密度均为1g/cm3,比热容为4.18J/(g•℃),写出该实验中和热的计算式:△H=
Ⅱ.(12分)影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol/L、2 mol/L、18.4 mol/L)。设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2 mol/L的硫酸于试管中 | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
| ②___________________ |
(1)甲同学表中实验步骤②为____________________________________________。
(2)甲同学的实验目的是______________________________________;要得出正确的实验结论,还需控制的实验条件是________。
乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行定量实验。
(3)乙同学在实验中应该测定的数据是______________。
(4)乙同学完成该实验应选用的实验药品是___________。
该实验中不选用某浓度的硫酸,理由是____________。
查看习题详情和答案>>
Ⅰ.(4分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
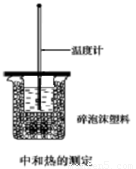
(1)从实验装置上看,图中尚缺少的一种玻璃用品 是 。
(2)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
(3)如果反应前后的温度差是(t2-t1),盐酸、氢氧化钠溶液的密度均为1g/cm3,比热容为 4.18J/(g•℃),写出该实验中和热的计算式:△H=
Ⅱ.(12分)影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol/L、2 mol/L、18.4 mol/L)。设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
|
实验步骤 |
现象 |
结论 |
|
①分别取等体积的2 mol/L的硫酸于试管中 |
反应速率Mg>Fe,Cu不反应 |
金属的性质越活泼,反应速率越快 |
|
②___________________ |
(1)甲同学表中实验步骤②为____________________________________________。
(2)甲同学的实验目的是______________________________________;要得出正确的实验结论,还需控制的实验条件是________。
乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行定量实验。
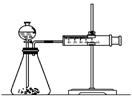
(3)乙同学在实验中应该测定的数据是______________。
(4)乙同学完成该实验应选用的实验药品是___________。
该实验中不选用某浓度的硫酸,理由是____________。
查看习题详情和答案>>
Ⅰ.已知测定中和热的实验步骤如下:①量取50mL 0.25mol/L硫酸倒入小烧杯中,测量温度 ②量取50mL 0.55mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。请回答:
(1)NaOH溶液稍过量的原因 。
(2)加入NaOH溶液的正确操作是 (填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是 。
(4)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18J·(g·℃)-1,请根据实验数据求出中和热为 写出该反应的热化学方程式_________
(5)若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量 (填“小于”、“等于”或“大于”)57.3 kJ,原因是
Ⅱ.某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用碱式滴定管量取25.00 mL烧碱溶液于锥形瓶中,并滴入几滴酚酞作指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为M的标准硫酸溶液装入润洗好的酸式滴定管中,调节液面使开始读数为V1 mL
E.在锥形瓶下垫一张白纸,滴定至溶液恰好由红色变为无色时,记下读数为V2 mL
试填空:
(1)正确操作步骤的顺序是 (用字母表示)。
(2)观察滴定管液面的高度时应注意
(3)E步骤的操作中锥形瓶下垫一张白纸的作用是 。
(4)某学生实验时把锥形瓶用烧碱样品溶液洗涤,使测定的浓度_________(填“偏高”“偏低”或“无影响”),原因是
(5)该烧碱样品纯度的计算式为_________________________。
查看习题详情和答案>>
某实验小组设计用50 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液进行中和反应,测定中和热,中和热测定实验的关键是要比较准确地配制一定物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)中和热的测定所需的玻璃仪器有 。
(2)本实验中用稍过量的NaOH的原因是 。
(3)在反应中若因为有放热现象,而造成少量HCl挥发,则测得的中和热数值 (填偏高、偏低或不变)。
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
| 实验序号 w. | 起始温度t1/℃ w.w.^w.k.&s.5*u.c.#om | 终止温度(t2)℃[来源:学科网ZXXK][来源:学。科。网] | 温差(t2-t1)℃[来源:Z+xx+k.Com] | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 w.w.^w.k.&s.5*u.c.#om | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 w.w.^w.k.&s.5*u.c.#om | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 w.w.^w.k.&s.5*u.c.#om | 31.9 w.w.^w.k.&s.5*u.c.#om | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混和液的比热容 C=4.18J/(g·℃)则该反应的中和热为△H=_______________________________。
(5)若用等浓度的醋酸代替盐酸与NaOH溶液反应,则测得的中和热的数值会 (填偏高、偏低或不变),其原因 ![]() 。
。
用50 mL0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液,在如图所示的装置中进行中和反应。测定强酸与强碱反应的反应热。
| | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1) /℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是______________________________。
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指______________________________温度。
(4)计算该实验发生中和反应时放出的热量为________________kJ(中和后生成的溶液的比热容c=4.18J/(g·℃ )。
(5) 如果用50 mL 0.55mol/L的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是
________________________ 。 查看习题详情和答案>>