摘要:22.(1),Ag++Br-=AgBr↓ .Br2.稀NaOH溶液.蒸馏水.分液漏斗.取少量最后一次洗液.加入稀HNO3.再加入AgNO3溶液.溶液不浑浊说明产品已洗净.(4)该反应是放热反应.反应物和白粉加入的量不适当.会使液溴挥发.挥发的液溴溶于水.生成HBr.与AgNO3反应生成AgBr沉淀.因而无法确定HBr是否与Br2取代反应的产物.Br2+H2O=HBr+HBrO HBr+AgNO3=AgBr↓+HNO3 (5)a是安全瓶.防止倒吸.b中度剂是苯或四氯化碳.装置Ⅱ的优点①控制反应进行 ②防止倒吸 ③排除液溴的干扰 ④防止有害气体污染环境
网址:http://m.1010jiajiao.com/timu3_id_37688[举报]
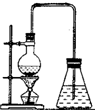 下图为某学生设计的制取溴苯的装置.
下图为某学生设计的制取溴苯的装置.(1)图中的错误之处是:①
不需酒精灯加热
不需酒精灯加热
②长导管伸到液面上方
长导管伸到液面上方
.(2)按加入的顺序,烧瓶中所装的试剂是
苯、液溴、铁粉
苯、液溴、铁粉
.(3)与烧瓶口连接的垂直向下的导管的作用是
导气和冷凝回流
导气和冷凝回流
.(4)反应完毕后,向锥形瓶中的溶液中滴入AgNO3溶液,现象是
出现淡黄色沉淀
出现淡黄色沉淀
,这是因为生成了AgBr
AgBr
,反应的离子方程式为Ag++Br-=AgBr↓
Ag++Br-=AgBr↓
;(5)反应完毕后,将烧瓶中的液体倒入盛有冷水的烧杯中,可以观察到烧杯底部有
褐
褐
色不溶于水的液体,这是因为溴苯的密度比水大,呈褐色,沉在烧杯的底部
溴苯的密度比水大,呈褐色,沉在烧杯的底部
的绦故.在粗产品溴苯中加入氢氧化钠
氢氧化钠
可以除去杂质Br2
Br2
,反应的离子方程式为Br2+2NaOH=NaBr+NaBrO+H2O
Br2+2NaOH=NaBr+NaBrO+H2O
;(6)烧瓶中发生反应的化学方程式为
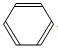 +Br2
+Br2| 催化剂 |
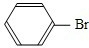 +HBr
+HBr +Br2
+Br2| 催化剂 |
 +HBr
+HBr