网址:http://m.1010jiajiao.com/timu3_id_376482[举报]
I.固体产物为MgO;Ⅱ.固体产物为Mg3N2;III.固体.产物为
已知:2NO2+2NaOH=NaNO3+H2O;Mg3N2与水发生剧烈反应.
回答下列问题:
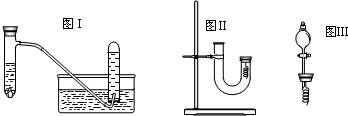
(1)利用下列仪器组装探究实验装置,按气流方向,正确的连接顺序是(每种仪器只用一次):
a接

(2)装置组装好后,检验气密性的方法是
(3)装置A中发生反应的离子方程式为
(4)装置C中盛装的干燥剂可以是(填序号)
①浓硫酸 ②无水CaCl2 ③碱石灰 ④五氧化二瞵
(5)实验开始时,先让A中反应进行一段时间,待B中充满红棕色气体后,再点燃B处酒精灯.这样做的目的是
(6)实验前镁粉的质量为12.00g,镁粉完全反应后得到的同一固体残留物称量了三次,所得数据分别是17.00g、18.02g、17.98go以上数据能否
(7)为了使测定结果更加准确,还需对组装好的装置进行的改进是
(1)写出试管内溶液中发生反应的化学方程式
(2)在实验过程中观察到试管内的溶液呈
(3)乙同学认为甲虽然收集到的气体是一氧化氮,但并不能说明反应中一定生成一氧化氮.他的理由是
有关化学方程式为:
(4)丙同学釆用如图Ⅱ所示装置进行实验,证明了铜与稀硝酸反应生成一氧化氮.该同学的步骤如下表所示,请回答实验中的有关问题.
| 实验步骤 | 问题 |
| 1从U型管左端加入稀硝酸直至充满U型管右端 | ∥/ |
| 2用附有铜丝的胶塞塞住U型管右端,观察现象 | 现象是 有无色气体产生,右边溶液逐渐变成绿色 有无色气体产生,右边溶液逐渐变成绿色 |
| 3待反应停止后打开胶塞,观察实验现象 | 现象是 无色气体与空气接触后立即变成红棕色 无色气体与空气接触后立即变成红棕色 |
(6)丁同学用图Ⅲ所示装置代替图Ⅱ中U型管右端的附有铜丝的胶塞进行实验,待反应停止后将一氧化氮气体排入分液漏斗中,观察到的实验现象与丙同学实验的第
(7)实验结束后丁同学向分液漏斗中注入适量水并充分振荡,试写出发生的化学反应方程式
(8)若将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L(不考虑NO2的反应),试回答:
①若铜与硝刚好反应完全,则原硝酸溶液的物质的量浓度为
②将产生的气体全部释放后,向溶液中加入VmL amol?L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的物质的量浓度为
| 10-3a﹒V +0.5 |
| 0.14 |
| 10-3a﹒V +0.5 |
| 0.14 |
③已知NO和NO2的混合气与足量氧气混合后能被水完全吸收成硝酸,则要使上述11.2L气体完全被水吸收成硝酸,理论上需消耗标准状况下的氧气
3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O
3 2
1.5xmol xmol
Cu+4HNO3(浓)=Cu(NO3 ) 2+2NO2↑+2H2O
1 2
| 1 |
| 2 |
所以方程组为
|
所以
|
即一氧化氮为0.26mol,二氧化氮为0.24mol.
4NO+2H2O+3O2=4HNO3
4 3
0.26mol 0.195mol
4 NO2+2H2O+O2=4HNO3
41
0.24mol 0.06mol
所以需要氧气0.195mol+0.06mol=0.255mol,体积为0.255mol×22.4L/mol=5.71L
3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O
3 2
1.5xmol xmol
Cu+4HNO3(浓)=Cu(NO3 ) 2+2NO2↑+2H2O
1 2
| 1 |
| 2 |
所以方程组为
|
所以
|
即一氧化氮为0.26mol,二氧化氮为0.24mol.
4NO+2H2O+3O2=4HNO3
4 3
0.26mol 0.195mol
4 NO2+2H2O+O2=4HNO3
41
0.24mol 0.06mol
所以需要氧气0.195mol+0.06mol=0.255mol,体积为0.255mol×22.4L/mol=5.71L
(12分)某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:甲+乙 丙+丁+水。
丙+丁+水。
(1)若丙为NO2。①甲与乙反应的化学方程式为  。
。
②NO2可作火箭重要燃料—肼(N2H4)的助燃剂。已知:
N2(g) + 2O2(g)=2NO2(g) △H= +67.7 kJ·mol-1,
2N2H4(g) + 2NO2(g)=3N2(g) + 4H2O(g) △H=-1135.7 kJ·mol-1。
写出燃料—肼(N2H4)燃烧生成氮气和水蒸气的热化学方程式:  。
。
(2)若丙为SO2。
①把乙滴入硫酸铜晶体,观察到的现象是 。
②SO2能使酸性KMnO4溶液紫红色褪去,完成下列离子方程式: MnO4- +
MnO4- +  SO2 +
SO2 +  =
=  Mn2+ +
Mn2+ +  SO42- +
SO42- +  H+
H+
③SO2在一定条件下,发生:2SO2(g)+O2(g) 2SO3(g) △H< 0反应。该反应的化学平衡常数K= (填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是 (填序号)。
2SO3(g) △H< 0反应。该反应的化学平衡常数K= (填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是 (填序号)。
a.x表示温度,y表示SO2的物质的量
b.x表示压强,y表示SO2的转化率
c.x表示SO2的物质的量,y表示O2的物质的量
d.x表示SO3的物质的量,y表示化学平衡常数K
(12分)某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:甲+乙丙+丁+水。
(1)若丙为NO2。①甲与乙反应的化学方程式为 。
②NO2可作火箭重要燃料—肼(N2H4)的助燃剂。已知:
N2(g)+ 2O2(g)=2NO2(g) △H= +67.7 kJ·mol-1,
2N2H4(g)+ 2NO2(g)=3N2(g) + 4H2O(g) △H=-1135.7 kJ·mol-1。
写出燃料—肼(N2H4)燃烧生成氮气和水蒸气的热化学方程式: 。
(2)若丙为SO2。
①把乙滴入硫酸铜晶体,观察到的现象是 。
②SO2能使酸性KMnO4溶液紫红色褪去,完成下列离子方程式:
MnO4- +
SO2 +
=
Mn2+ +
SO42- +
H+
③SO2在一定条件下,发生:2SO2(g)+O2(g)2SO3(g) △H<0反应。该反应的化学平衡常数K= (填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是 (填序号)。
a.x表示温度,y表示SO2的物质的量
b.x表示压强,y表示SO2的转化率
c.x表示SO2的物质的量,y表示O2的物质的量
d.x表示SO3的物质的量,y表示化学平衡常数K
查看习题详情和答案>>
(9分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
⑴NO2可用水吸收,相应的化学反应方程式为____________________________。利用反应6NO2+ 8NH3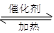 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是
L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是
L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
查看习题详情和答案>>