网址:http://m.1010jiajiao.com/timu3_id_376355[举报]
(1)在一密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| K | 4.1×106 | K1 | K2 |
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是
a.υ(N2)正=3υ(H2)逆
b.容器内N2、H2、NH3的浓度之比为1:3:2
c.容器内压强保持不变
d.混合气体的平均相对分子质量保持不变
(2)298K时,1.00g N2H4(l)与足量的N2O4(l)完全反应生成氮气和液态水,放出19.15kJ的热量.写出该反应的热化学方程式
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收原料气中的CO,其反应是:

[Cu(NH3)2]Ac+CO+NH3?[Cu(NH3)3]Ac?C
| O |
生产中必须除去原料气中CO的原因是
(4)对反应2NO2(g)?N2O4(g)△H<0在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是
a.A、C两点的反应速率:A>C
b.A、C两点NO2的转化率:A<C
c.B、C两点的气体的平均相对分子质量:B<C
d.由状态B到状态A,可以用加热的方法.
(1)在一密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如下表:
| T | 298K | 398K | 498K | … |
| K | 4.1×106 | K1 | K2 | … |
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是
a.2v正(H2)=3v逆(NH3) b.v正(N2)=3v逆(H2)
c.容器内压强保持不变 d.混合气体的平均摩尔质量保持不变
③若维持容器的体积不变,达到平衡状态后再向容器中通入一定量的N2,此时逆反应速率
④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,则Ksp(AgCl)
(2)肼是氮元素的另一种氢化物,分子式为N2H4.
①写出肼的电子式
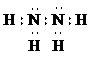
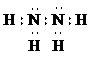
②298K时,1.00g N2H4(l)与足量的N2O4(l)完全反应生成氮气和水,放出19.15kJ的热量.写该反应的热化学方程式
③肼也可以在纯氧中燃烧生成氮气和水,为了充分利用其能量有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式
在一密闭容器中,进行mX(s)+nY(g)![]() 2Z(g);ΔH=Q的反应中,下列结论正确的是( )
2Z(g);ΔH=Q的反应中,下列结论正确的是( )
A.缩小容器的体积,发现混合气体的密度增大,则n一定大于2
B.加入一些X,平衡一定往右移动,可以提高Y的转化率
C.升高温度,正反应、逆反应速率同时增大,X和Y的质量增加,说明Q>0
D.若增大压强,Z的百分含量不变,则m+n>2
查看习题详情和答案>>
氮元素有着多变价态和种类繁多的化合物,它们在工农业生产、生活中发挥着重要的作用。完成下列问题:
(1)在一密闭容器中,进行如下化学反应:
N2(g)+3H2(g)![]() 2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
| T | 298 K | 398 K | 498 K | … |
| K | 4.1×106 | K1 | K2 | … |
①比较K1、K2的大小:K1______K2(填“>”、“=”或“<”)。
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是________(填序号)。
a.2v(H2)正=3v(NH3)逆 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的平均摩尔质量保持不变
③若维持容器的压强不变,达到平衡状态后再向容器中通入一定量的N2,此时逆反应速率______(填“增大”、“减小”或“不变”);平衡向_____方向移动。
④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,则Ksp(AgCl)______ Ksp(AgBr)。
( 2 )肼是氮元素的另一种氢化物,分子式为N2H4。
①298 K时,1.00 g N2H4(l)与足量的N2O4(l)完全反应生成氮气和水,放出19.15 kJ的热量。写该反应的热化学方程式_____________________________________。
②肼也可以在纯氧中燃烧生成氮气和水,为了充分利用其能量有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式_________________。
查看习题详情和答案>>