网址:http://m.1010jiajiao.com/timu3_id_376348[举报]
2CO2(g)+6H2(g)
| ||
| △ |
(1)写出该反应的平衡常数表达式:K=
| c3(H2O)×c(CH3CH2OH) |
| c2(CO2)×c6(H2) |
| c3(H2O)×c(CH3CH2OH) |
| c2(CO2)×c6(H2) |
(2)在一定压强和温度下,在反应物总物质的量相同的情况下,测得该反应的实验数据如下表:
| 温度/℃CO2转化率/% n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
②提高氢碳比[n(H2)/n(CO2)],则CO2的转化率
(3)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇与氧气作用生成水和二氧化碳.该电池的负极反应式为:
若以上述燃料电池为电源来电解饱和食盐水,当消耗46g乙醇时,电解产生的H2体积(标况)为
(4)25℃、101kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ?mol-1、1411.0kJ?mol-1和1366.8kJ?mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)
(1)写出该反应的平衡常数表达式:K=
| c(CH3OH)c3(H2O) |
| c2(CO2)c6(H2) |
| c(CH3OH)c3(H2O) |
| c2(CO2)c6(H2) |
(2)请说明以CO2为原料合成乙醇的优点是
(3)在一定压强下,测得该反应的实验数据如下表:
| 温度/℃CO2转化率/% n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
②一定条件下,若提高氢碳比[n(H2)/n(CO2)],则CO2的转化率
(4)在下图的坐标系中作图说明压强变化对该反应化学平衡的影响,并对图中横坐标、纵坐标的含义作必要的标注.

(5)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇与氧作用生成水和二氧化碳.该电池的负极反应式为:
(6)25℃、101kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ?mol-1、1411.0kJ?mol-1和1366.8kJ?mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式
(15分)氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂和生产含氟牙膏等。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:
有关物质在水中溶解度(g/100gH2O)如下:
|
温度 |
10℃ |
20℃ |
30℃ |
溶解度:20℃NaF—4 0℃NH4F—100; 常温Na2SiF6微溶于水 |
|
NH4Cl溶解度 |
33.3 |
37.2 |
41.4 |
请回答下列问题:
(1)操作Ⅰ需要用到的玻璃仪器有 。
(2)上述流程中发生两步反应,化学方程式为:
(3)操作II的作用是
操作Ⅲ的具体过程是
(4)流程中NH4HCO3必须过量,其原因是
_______________________________________________________________________
查看习题详情和答案>>
(15分)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g)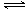 H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
试回答下列问题:
⑴下列措施中有利于提高尿素的产率的是___________。
A.采用高温
B.采用高压
C.寻找更高效的催化剂
⑵合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g)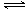 H2NCOONH4(氨基甲酸铵) (l) △H1
H2NCOONH4(氨基甲酸铵) (l) △H1
第二步:H2NCOONH4(l)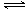 H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_____步反应决定,总反应进行到_________min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_______________________。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2__________0(填“>”“<”或“=”)
查看习题详情和答案>>