网址:http://m.1010jiajiao.com/timu3_id_376030[举报]
 Ⅰ.下列实验方案不可行的是:______
Ⅰ.下列实验方案不可行的是:______
A.用品红溶液鉴别CO2和SO2气体 B.用铜制容器盛放浓硝酸
C.用带玻璃塞的试剂瓶盛放NaOH溶液 D.用NH3和H2O做喷泉实验
E.除去 N2 中少量的O2用灼热的铜网 F.所有剩余的药品都不能放回原瓶
G.制Fe(OH)2时可将吸有NaOH溶液的滴管伸入到Fe SO4溶液液面以下
Ⅱ.实验室制配0.5mol/L的NaOH溶液500mL.
(1)配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀⑤转移 ⑥洗涤 ⑦定容 ⑧冷却.其正确的操作顺序为______.
(2)试分析下列操作对所配溶液的浓度有何影响.(填“偏高”、“偏低”或“无影响”)
①定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,对所配溶液浓度的影响______.
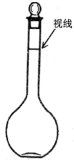
②某同学观察液面的情况如右图所示,则所配置的溶液的浓度______.
(3)取出其中50mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为______.
查看习题详情和答案>>
A.用品红溶液鉴别CO2和SO2气体 B.用铜制容器盛放浓硝酸
C.用带玻璃塞的试剂瓶盛放NaOH溶液 D.用NH3和H2O做喷泉实验
E.除去 N2 中少量的O2用灼热的铜网 F.所有剩余的药品都不能放回原瓶
G.制Fe(OH)2时可将吸有NaOH溶液的滴管伸入到Fe SO4溶液液面以下
Ⅱ.实验室制配0.5mol/L的NaOH溶液500mL.
(1)配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀⑤转移 ⑥洗涤 ⑦定容 ⑧冷却.其正确的操作顺序为______.
(2)试分析下列操作对所配溶液的浓度有何影响.(填“偏高”、“偏低”或“无影响”)
①定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,对所配溶液浓度的影响______.
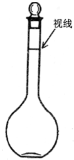
②某同学观察液面的情况如右图所示,则所配置的溶液的浓度______.
(3)取出其中50mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为______.
A.用品红溶液鉴别CO2和SO2气体 B.用铜制容器盛放浓硝酸
C.用带玻璃塞的试剂瓶盛放NaOH溶液 D.用NH3和H2O做喷泉实验
E.除去 N2 中少量的O2用灼热的铜网 F.所有剩余的药品都不能放回原瓶
G.制Fe(OH)2时可将吸有NaOH溶液的滴管伸入到Fe SO4溶液液面以下
Ⅱ.实验室制配0.5mol/L的NaOH溶液500mL.
(1)配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀⑤转移 ⑥洗涤 ⑦定容 ⑧冷却.其正确的操作顺序为______.
(2)试分析下列操作对所配溶液的浓度有何影响.(填“偏高”、“偏低”或“无影响”)
①定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,对所配溶液浓度的影响______.
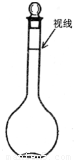
②某同学观察液面的情况如右图所示,则所配置的溶液的浓度______.
(3)取出其中50mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为______.
 查看习题详情和答案>>
查看习题详情和答案>>
(9分)酸碱中和滴定是中学化学常见实验。
某同学欲测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A.冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。
B.量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D.将物质的量浓度为1.50mol/L标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。
E.继续滴定至终点,记下读数为V2。
F.在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G.量取浓硫酸样品5mL,在烧杯中用蒸馏水稀释。
H.重复以上实验。
请回答下列问题:
(1)该实验正确操作步骤的顺序为 → A→ → →D→ → → H
(用编号字母填写)。
(2)量取5mL浓硫酸的仪器是 ;量取20.00mL稀硫酸的仪器是 。
(3)选用的指示剂是 。滴定过程中,视线应注视 ;判断到达滴定终点的现象是 。
(4)下表是实验测得的有关数据:
|
滴定序号 |
待测稀硫酸的体积(mL) |
所消耗NaOH标准溶液液的体积(mL) |
|
|
V1 |
V2 |
||
|
① |
20.00 |
0.50 |
22.60 |
|
② |
20.00 |
6.00 |
27.90 |
请计算出该浓硫酸样品的浓度为 mol·L-1(不必写出计算过程)。
查看习题详情和答案>>
(9分)酸碱中和滴定是中学化学常见实验。
某同学欲测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A.冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。
B.量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D.将物质的量浓度为1.50mol/L标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。
E.继续滴定至终点,记下读数为V2。
F.在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G.量取浓硫酸样品5mL,在烧杯中用蒸馏水稀释。
H.重复以上实验。
请回答下列问题:
(1)该实验正确操作步骤的顺序为 →A→ → →D→ → → H
(用编号字母填写)。
(2)量取5mL浓硫酸的仪器是 ;量取20.00mL稀硫酸的仪器是 。
(3)选用的指示剂是 。滴定过程中,视线应注视 ;判断到达滴定终点的现象是 。
(4)下表是实验测得的有关数据:
| 滴定序号 | 待测稀硫酸的体积(mL) | 所消耗NaOH标准溶液液的体积(mL) | |
| V1 | V2 | ||
| ① | 20.00 | 0.50 | 22.60 |
| ② | 20.00 | 6.00 | 27.90 |
请计算出该浓硫酸样品的浓度为 mol·L-1(不必写出计算过程)。
查看习题详情和答案>>