网址:http://m.1010jiajiao.com/timu3_id_375977[举报]
B.用硫磺熏制白木耳、粉丝等食品
C.用工业用盐腌制肉类食品
D.将水产品浸泡在甲醛水溶液中保鲜
| |||||||||||||||||||||||||
(14分)近几年来,我国中东部地区陷入严重的雾霾天气,面对全球近期的气候异常,环境问题再次成为焦点。非金属氧化物的合理控制和治理是优化我们生存环境的有效途径之一。请运用化学反应原理知识,回答下列问题:
Ⅰ、目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-57kJ?mol-1
②4CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1
③H2O(g)=H2O(l) △H=-44.0kJ?mol-1
写出CH4(g)与NO2(g)反应生成N2(g),CO2(g)和H2O(l)的热化学方程式________________。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+ 2NO(g) N2(g)+CO2(g)某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度(mol/L) 时间(min) | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
②30 min后改变某一条件,反应重新达到平衡,则改变的条件可能是___________________。
③若30min后升高温度重新达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应
△H_________0(填“<”“>”“=”)。
Ⅱ、某科研小组为治理SO2对大气的污染,利用烟气中的SO2为原料制取硫酸。
(1)利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池负极的电极反应式__________。
(2)利用Na2SO3溶液充分吸收SO2制得NaHSO3溶液。
①常温时吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
A.NaHSO3溶液中c(H+)<c (OH-)
B.Na2SO3溶液中c(Na+)>c (SO32-)>c (HSO3-)>c (OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c (HSO3-)>c (SO32-)>c(OH-)=c(H+)
D.当n(SO32-):n(HSO3-)=1:1时,c(Na+)=c (HSO3-)+2c (SO32-)
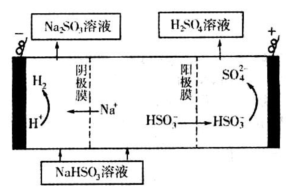
②然后电解该NaHSO3溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式______________________________________。
 查看习题详情和答案>>
查看习题详情和答案>>
Ⅰ、目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-57kJ?mol-1
②4CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1
③H2O(g)=H2O(l) △H=-44.0kJ?mol-1
写出CH4(g)与NO2(g)反应生成N2(g),CO2(g)和H2O(l)的热化学方程式________________。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+ 2NO(g)
 N2(g)+CO2(g)某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:| 浓度(mol/L) 时间(min) | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
②30 min后改变某一条件,反应重新达到平衡,则改变的条件可能是___________________。
③若30min后升高温度重新达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应
△H_________0(填“<”“>”“=”)。
Ⅱ、某科研小组为治理SO2对大气的污染,利用烟气中的SO2为原料制取硫酸。
(1)利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池负极的电极反应式__________。
(2)利用Na2SO3溶液充分吸收SO2制得NaHSO3溶液。
①常温时吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
A.NaHSO3溶液中c(H+)<c (OH-)
B.Na2SO3溶液中c(Na+)>c (SO32-)>c (HSO3-)>c (OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c (HSO3-)>c (SO32-)>c(OH-)=c(H+)
D.当n(SO32-):n(HSO3-)=1:1时,c(Na+)=c (HSO3-)+2c (SO32-)
②然后电解该NaHSO3溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式______________________________________。
Ⅰ.下表是某食品包装上的说明,表中列出了部分配料.
| 品 名 | 浓缩菠萝汁 |
| 配 料 | ①浓缩菠萝汁 ②蔗糖 ③柠檬黄 ④山梨酸钾 ⑤水 |
| 果汁含量 | ≥80% |
| 生产日期 | 标于包装封口处 |
(2)从上表中可以分析得知,该食品主要提供______等三种营养素.
Ⅱ.(1)我国中南地区,通常情况下,雨水量相同的元月份与8月份比较,______(填:“前者”或“后者”)的雨水的酸性较高.
(2)汽车尾气需要用催化转换器减少有毒气体的排放.写出汽车尾气中CO、NO相互作用生成可参与大气循环的气体的化学方程式:______.
(3)用氯气对居民饮用水进行消毒已有百年历史,但科学研究表明,用氯气对自来水消毒时,氯气能和水中的微量有机物反应生成氯代烃等多种有毒物质.因此,逐步被具有不同优点的铁酸钠(Na2FeO4)、氯胺(NH2Cl)、二氧化氯(ClO2)等消毒剂所替代.?
①铁酸钠(Na2FeO4)起消毒作用后,它同时具有净水作用,其理由:______(用离子方程式表示).
②氯胺(NH2Cl)比次氯酸稳定,可与水作用逐步产生次氯酸,用化学方程式表示氯胺与水的反应:______.
③二氧化氯(ClO2)具有很强的氧化性,与Cl2相比是一种高效消毒剂,其原因是______.
Ⅲ.阅读并回答问题:
2009年12月哥本哈根气候变化峰会的主题是减少二氧化碳的排放、控制温室效应.世界上没有垃圾,只有放错了地方的财富.人类在认识到二氧化碳副作用的同时,应积极寻找并拓展其利用空间.上海世博会已成为低碳世博会.“四川馆”率先采用世界上最新的建筑装饰材料--大豆纤维.中国是唯一拥有“大豆纤维”完全知识产权的国家.“大豆纤维”主要原料是大豆蛋白质和高分子聚乙烯醇,它属于可降解性再生植物蛋白纤维,该纤维具有天然纤维和化学纤维的许多优良性能,被国内外专家誉为“21世纪健康舒适型纤维”.
下列说法不正确的是______
A.二氧化碳无毒、分子结构稳定,它可以用于做焊接保护气体.
B.发展二氧化碳地质封存技术并将其与石油开采结合起来,既能减少二氧化碳排放,又实现了石油的绿色开发.
C.从空气中提取CO2,成本较高,如果从冶金、火力发电等工厂排放的烟气中提取二氧化碳,提取成本将大大降低.
D.碳酸饮料中的二氧化碳能够被人体吸收,不会排放到空气中去.
E.不能使用含生物酶的洗涤剂洗涤大豆纤维布料的衣服.
F.大豆纤维是利用大豆中的油脂通过聚合反应合成的.
G.大豆纤维属于合成高分子化合物.
H.废弃的大豆纤维可能造成“白色污染”,最好用填埋法处理.
