网址:http://m.1010jiajiao.com/timu3_id_37555[举报]
最新选择题专项训练
2005年2月18日英国食品标准署就食用含有添加苏丹红色素的食品可能诱发癌症向消费者发出警告。我国也已开始追查含苏丹红色素的食品。所谓“苏丹红一号”实际上一般称为“苏丹一号”,是一种黄溶剂染料,按化学染料分类称为溶剂黄14(C.L.Solvent,Yellow14),分子式为C16H12N2O,其化学结构属偶氮类染料,是由苯胺重氮化后与2-萘酚偶合制得。有关苏丹红一号下列说法正确的是( )
A.苏丹红一号在食品中能起到增色的作用,可在辣椒酱中用作添加剂
B.苏丹红一号的摩尔质量为248
C.苏丹红一号可用于溶解剂、机油、蜡和鞋油等产品的染色
D.食品添加剂对人体危害较大,因此应全面禁止使用。
NA为阿佛加德罗常数,下述正确的是 ( )
A.80g硝酸铵含有氮原子数为2NA
B.1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA
C.标准状况下,11.2L四氯化碳所含分子数为0.5 NA
D.在铜与硫的反应中,1mol铜失去的电子数为2 NA
在pH =1的无色溶液中能大量共存的离子组是 ( )
A.NH4+、Mg2+、SO42-、Cl- B.Ba2+、K+、OH-、NO3-
C.Al3+、Cu2+、SO42-、Cl- D.Na+、Ca2+、Cl-、AlO2-
拟除虫菊酯是一类高效、低毒、对昆虫具有强
烈触杀作用的杀虫剂,其中对光稳定的溴氰
菊酯的结构简式如右图:
下列对该化合物叙述正确的是( )
A.属于芳香烃 B.属于卤代烃
C.在酸性条件下不水解 D.在一定条件下可以发生加成反应
可以将反应Zn+Br2=ZnBr2设计成蓄电池,下列4个反应 ①Br2+2e=2Br-②2Br—2e=Br2③Zn-2e=Zn2+④Zn2++2e=Zn其中表示充电时的阳极反应和放电时的负极反应的是
A ②和③ B ②和① C ③和① D ④和①
NaH是—种离子化合物,它跟水反应的方程式为:NaH+H2O→NaOH+H2↑,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气。下列有关NaH的叙述错误的是( )
A 跟水反应时,水作氧化剂 B NaH中H-半径比Li+半径小
C 跟液氨反应时,有NaNH2生成 D 跟乙醇反应时,NaH被氧化
右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )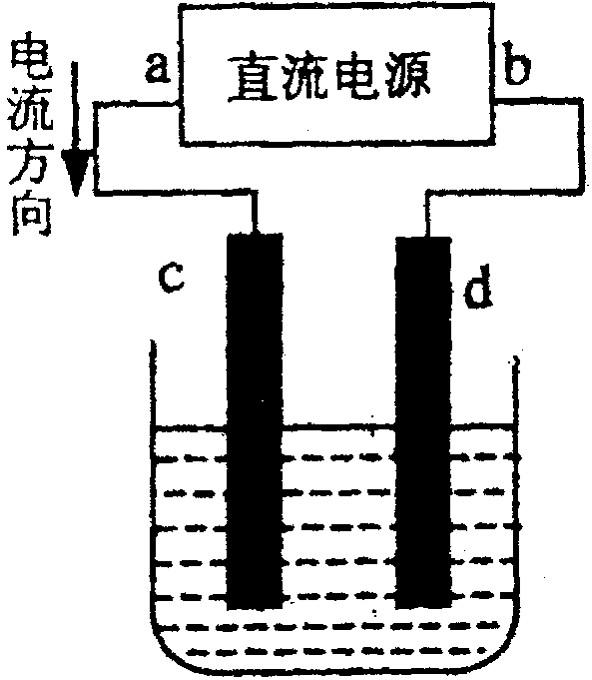
A a为负极、b为正极 B a为阳极、b为阴极
C 电解过程中,d电极质量增加
D 电解过程中,氯离子浓度不变
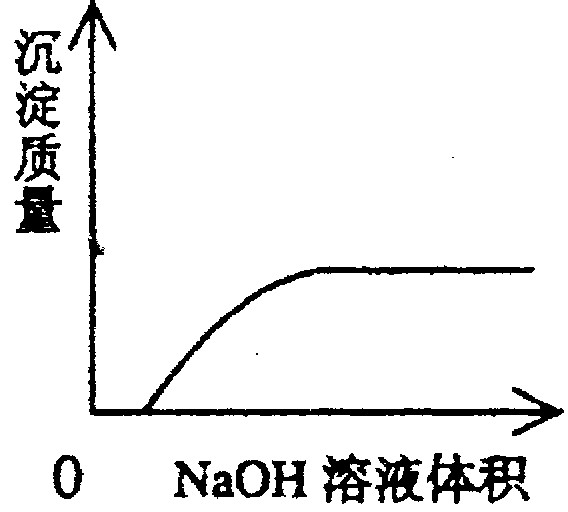
下列实验过程中产生的现象与对应的图形相符合的是
A NaHSO3粉末加入HNO3溶液中 B H2S气体通入氯水中
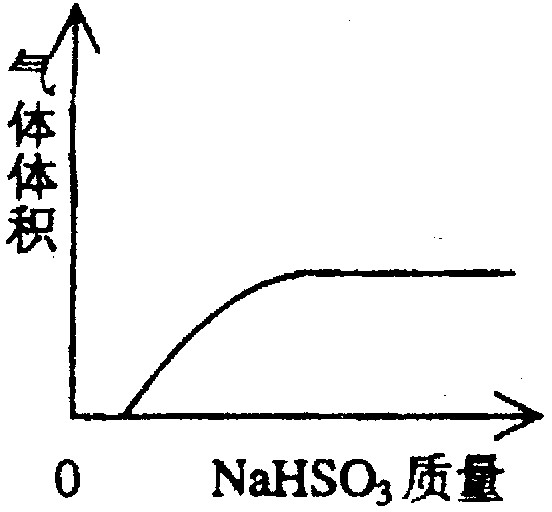
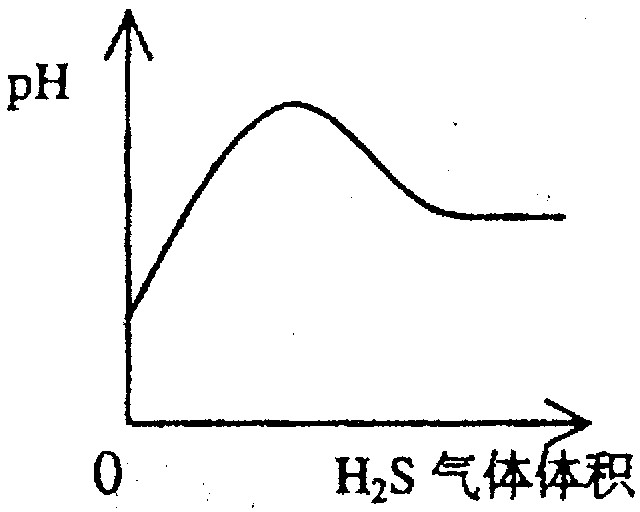
C NaOH溶液滴入Ba(HCO3)2溶液中 D CO2气体通入澄清石灰水中

是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为( )
A 1︰1 B 2︰1 C 1︰2 D 2︰3
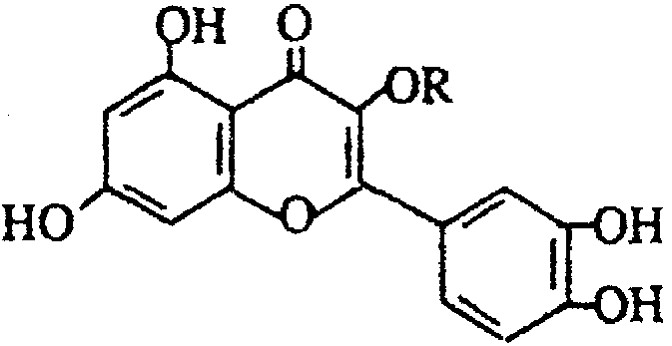
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是
A 可以和溴水反应 B 可用有机溶剂萃取
C 分子中有三个苯环 D 1mol维生素P可以和4molNaOH反应
下图中能验证氯化钠溶液(含酚酞)电解产物的装置是
A、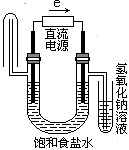 B、
B、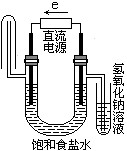
C、 D、
D、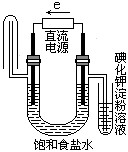
CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同。以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是
A、将两种样品分别溶于硝酸,区别所产生的气体
B、将两种样品分别溶于硝酸,区别溶液的颜色
C、取两种同质量的样品分别在高温中灼烧,区别残留固体的质量
D、取两种同质量的样品分别在高温中灼烧,区别残留固体的颜色
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 molCu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为( )
A、0.1 mol B、0.2 mol C、0.3 mol D、0.4 mol
下列各组气体或溶液用括号试剂加以鉴别,其中不合理的是
A、二氧化碳、二氧化硫、一氧化碳(品红溶液)B、酒精、醋酸、醋酸钠(石蕊试液
C、氯化钠、硝酸银、碳酸钠(稀盐酸) D、硫酸、硝酸钡、氯化钾(碳酸钠溶液)
查看习题详情和答案>>
(Ⅰ)下列实验操作或对实验事实的描述正确的是 (填序号);
① 实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉。
② 配制一定浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高;实验室测定中和热时,过早读数会使测定结果偏低。
③ 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末
④ 实验室用铜片与稀硝酸反应产生的气体可用排水法收集
⑤ 试管中加入少量淀粉,再加入一定量稀硫酸,加热3-4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现
⑥ 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑦ 苯与溴水在铁粉的催化作用下制备溴苯
⑧ 分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
Ⅱ.在中学化学实验中,通常用无水硫酸铜来检验少量水的存在。由于无水硫酸铜吸湿性很强,需要现制现用。
方法甲:取2药匙细小的硫酸铜晶体置于_______中研碎后放入坩埚,将坩埚放在______上用小火慢慢加热并用玻璃棒不停搅拌,最后将坩埚移入___________中进行冷却(请选用合适仪器填空:表面皿、研钵、烧杯、通风橱、试管夹、干燥器、泥三角)。
方法乙:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20 mL浓硫酸(质量分数不低于98%),并用玻璃棒搅拌,静置5 min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干。
【交流与讨论】
(1)方法甲中,加热温度稍高时会出现变黑现象,原因是_________(用化学方程式表示)。
(2)方法乙中,浓硫酸的作用是__________;为了不浪费药品,对无水乙醇洗涤液进行再生的方法是______ ,所用的主要玻璃仪器有烧瓶、接液管、锥形瓶、酒精灯________________等。
(3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想______________。
 (4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4•5H2O的新工艺。模拟制备装置如下图所示。
(4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4•5H2O的新工艺。模拟制备装置如下图所示。
【问题一】如图装置中,分液漏斗内装的液体是________,反应结束时,获取CuSO4•5H2O的操作过程是先________________,趁热将三颈瓶中的液体倒入烧杯中冷却,析出晶体CuSO4?5H2O ,过滤、晾干。
【问题二】工业上用石灰乳吸收尾气,除了防止环境污染外,还能得到了有经济实用价值的副产品―― 亚硝酸钙。尾气吸收生成亚硝酸钙的化学方程式是_______________。
查看习题详情和答案>> SO3(g);ΔH=-98.3 kJ·mol-1
SO3(g);ΔH=-98.3 kJ·mol-1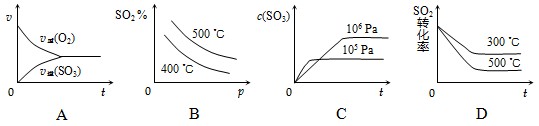
 SO3(g);ΔH=-98.3
kJ·mol-1
SO3(g);ΔH=-98.3
kJ·mol-1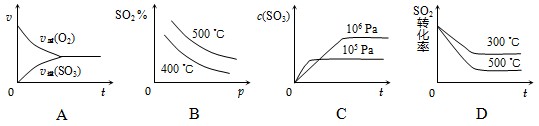
 SO3(g);ΔH=-98.3 kJ·mol-1
SO3(g);ΔH=-98.3 kJ·mol-1