摘要:1.漂白粉在溶液中存在下列平衡ClO-+H2O HClO+OH-.下列措施能提高其漂白效益的是( ) A.加水稀释 B.通入CO2 C.加适量盐酸 D.加少量NaOH
网址:http://m.1010jiajiao.com/timu3_id_375329[举报]
漂白粉在溶液中存在下列平衡:ClO- +
H2O 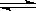 HClO
+ OH-,下列措施能提高漂白效果的是(
)
HClO
+ OH-,下列措施能提高漂白效果的是(
)
A、加水稀释 B、加入适量NaOH C、通入少量SO2 D、加入适量盐酸
查看习题详情和答案>>
 氯气是重要的化工原料.
氯气是重要的化工原料.(1)氯气溶于水得到氯水,氯水中存在下列反应:Cl2+H2O?H++Cl-+HClO,其平衡常数表达式为K=
| C(H+)C(Cl-)C(HClO) |
| C(Cl2) |
| C(H+)C(Cl-)C(HClO) |
| C(Cl2) |
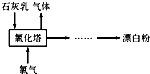
(2)工业上常用消石灰和氯气反应制取漂白粉,化学反应方程式是
2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O
2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O
.流程如图所示,其主要设备是氯化塔,塔从上到下分四层.将含有3%~6%水分的熟石灰从塔顶喷洒而入,氯气从塔的最底层通入,这样加料的目的是充分接触,充分反应
充分接触,充分反应
.处理从氯化塔中逸出气体的方法是用碱液来吸收
用碱液来吸收
.(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是
6OH-+3Cl2
ClO3-+5Cl-+3H2O
| ||
6OH-+3Cl2
ClO3-+5Cl-+3H2O
,其原因可能是
| ||
反应放热,温度升高,发生了副反应
反应放热,温度升高,发生了副反应
,由此可知(2)中氯化塔设计为四层是为了减少生产中类似副反应的发生.中学化学常见的物质A、B、C、D之间存在如下转化关系:A+B→C+D+H2O(没有配平).请按要求填空:
(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体.C、D两种气体均能使澄清石灰水变浑浊,则该反应的化学方程式是:
a.BaCl2溶液 b.KMnO4溶液 c.品红溶液 d.酸化的Ba(NO3)2溶液
向500mL2mol/L的NaOH溶液中通入0.8mol无色无味的C气体,恰好完全反应,该反应的化学方程式是
(2)若A为红色金属单质,与适量B的溶液在常温下恰好完全反应,生成的无色气体C遇空气迅速变成经棕色.若被还原的B物质的量为2mol时,产生C气体的体积是
(3)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质;D是漂白粉的成分之一.C发生水解反应的离子方程式是
(4)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体.检验A中阴离子的方法是
查看习题详情和答案>>
(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体.C、D两种气体均能使澄清石灰水变浑浊,则该反应的化学方程式是:
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
,鉴别这两种气体不能选用的试剂是
| ||
a
a
a.BaCl2溶液 b.KMnO4溶液 c.品红溶液 d.酸化的Ba(NO3)2溶液
向500mL2mol/L的NaOH溶液中通入0.8mol无色无味的C气体,恰好完全反应,该反应的化学方程式是
5NaOH+4CO2═Na2CO3+3NaHCO3+H2O
5NaOH+4CO2═Na2CO3+3NaHCO3+H2O
.此时溶液中的离子按照浓度由大到小排列的顺序是c(Na+)>c(HCO3-)>c(CO3 2- )>c(OH-)>c(H+)
c(Na+)>c(HCO3-)>c(CO3 2- )>c(OH-)>c(H+)
.(2)若A为红色金属单质,与适量B的溶液在常温下恰好完全反应,生成的无色气体C遇空气迅速变成经棕色.若被还原的B物质的量为2mol时,产生C气体的体积是
44.8
44.8
L(标况).将生成的红棕色气体通入一个烧瓶里,塞紧瓶塞后,将烧瓶浸入冰水中,烧瓶中气体的颜色变浅,请用化学方程式和必要的文字解释颜色变化的原因2NO2(红棕色)?N2O4(无色);△H<0,降温,平衡向正反应方向移动,红棕色NO2浓度减小,混合气体的颜色变浅
2NO2(红棕色)?N2O4(无色);△H<0,降温,平衡向正反应方向移动,红棕色NO2浓度减小,混合气体的颜色变浅
.(3)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质;D是漂白粉的成分之一.C发生水解反应的离子方程式是
ClO-+H2O?HClO+OH-
ClO-+H2O?HClO+OH-
(4)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体.检验A中阴离子的方法是
取少量A于一洁净试管中,加蒸馏水溶解后,滴加硝酸银溶液,产生白色没淀,再滴加稀硝酸,振荡,沉淀不溶解,则A的阴离子为Cl-
取少量A于一洁净试管中,加蒸馏水溶解后,滴加硝酸银溶液,产生白色没淀,再滴加稀硝酸,振荡,沉淀不溶解,则A的阴离子为Cl-
(简述操作过程及结论). HClO + OH-,下列措施能提高漂白效果的是( )
HClO + OH-,下列措施能提高漂白效果的是( )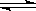 HClO + OH-,下列措施能提高漂白效果的是( )
HClO + OH-,下列措施能提高漂白效果的是( )