网址:http://m.1010jiajiao.com/timu3_id_374809[举报]
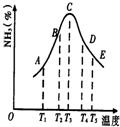 在容积不同的多个密闭容器内,分别充入同量的N2和H2,在不同温度下,同时发生反应N2+3H2?2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如图:
在容积不同的多个密闭容器内,分别充入同量的N2和H2,在不同温度下,同时发生反应N2+3H2?2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如图:(1)A,B,C,D,E五点中,尚未达到化学平衡状态的点是
(2)向一恒容容器中加入1mol N2和3mol H2,T3时,测得体系压强为原来的
| 7 | 8 |
(3)当上述反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3
产率的有
A 升高温度 B 降低温度 C 增大压强 D 减小压强
E 加入催化剂 F 吸收NH3 G 通入N2
(4)AC段的曲线和CE段曲线变化趋势相反,试从反应速率和平衡角度说明理由.
(18分)在容积不同的多个密闭容器内,分别充入同量的N2和H2,在不同温度下,同时发生反应N2+3H2 2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:

(1)A,B,C,D,E五点中,尚未达到化学平衡状态的点是 。
(2) 向一恒容容器中加入1 mol N2 和3 mol H2,T3时,测得体系压强为原来的7/8,并放出23.1 kJ的热量,则该反应的热化学方程式为 。
(3)当上述反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3产率的有 (填字母)
A.升高温度 B.降低温度 C.增大压强 D.减小压强
E.加入催化剂 F.吸收NH3 G.通入N2
(4)AC段的曲线和CE段曲线变化趋势相反,试从反应速率和平衡角度说明理由。
。
查看习题详情和答案>>
(18分)在容积不同的多个密闭容器内,分别充入同量的N2和H2,在不同温度下,同时发生反应N2+3H2 2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
(1)A,B,C,D,E五点中,尚未达到化学平衡状态的点是 。
(2) 向一恒容容器中加入1 mol N2 和3 mol H2,T3时,测得体系压强为原来的7/8,并放出23.1 kJ的热量,则该反应的热化学方程式为 。
(3)当上述反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3产率的有 (填字母)
| A.升高温度 | B.降低温度 | C.增大压强 | D.减小压强 |
(4)AC段的曲线和CE段曲线变化趋势相反,试从反应速率和平衡角度说明理由。
。 查看习题详情和答案>>
在容积不同的多个密闭容器内,分别充入同量的N2和H2,在不同温度下,同时发生反应N2+3H2![]() 2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
(1)A,B,C,D,E五点中,尚未达到化学平衡状态的点是 。
(2) 向一恒容容器中加入1 mol N2 和3 mol H2,T3时,测得体系
压强为原来的7/8,并放出23.1 kJ的热量,则该反应的热化学方程式
为 。
(3)当上述反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3
产率的有 (填字母)
A 升高温度 B 降低温度 C 增大压强 D 减小压强
E 加入催化剂 F 吸收NH3 G 通入N2
(4)AC段的曲线和CE段曲线变化趋势相反,试从反应速率和平衡角度说明理由。
。

(12分)在一定条件下,可逆反应A + B![]() mC变化如右图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC变化如右图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
⑴温度T1 T2(填大于、等于或小于)
⑵正反应是 反应(填“吸热”或“放热”)
⑶如果A、B、C均为气体,则m 2(填大于、等于或小于)
⑷当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,
则体系的压强 (填增大、减小或不变),平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”)
22.
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填“吸热”、“放热”)。
(3)能判断该反应已经达到化学平衡状态的依据是 (多选扣分)。
A、容器中压强不变;B、混合气体中c(CO)不变;C、v正(H2)=v逆(H2O);D、c(CO2)=c(CO)。
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃
23. (12分)在密闭容器中将NO2加热到某温度时,进行如下的反应:2NO2![]() 2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NO2)=0.06 mol/L,c(NO)=0.24 mol/L。试求:
2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NO2)=0.06 mol/L,c(NO)=0.24 mol/L。试求:
⑴NO2的转化率为?
⑵反应前后的压强比为多少?
⑶在这5分钟内,用O2来表示的平均反应速率是多少?
查看习题详情和答案>>