摘要:在一个5L的密闭容器中充入2molA和1molB,在一定条件下发生可逆反应: 2A,4min后达到平衡,测得C的物质的量浓度为
网址:http://m.1010jiajiao.com/timu3_id_374387[举报]
短周期元素X、Y、Z原子序数依次递增.X、Y、Z的最外层电子数之和为13,Y是所在周期中金属性最强的,X、Z在同一主族.
(1)Z元素在周期表中的位置是
(2)Y2ZX3溶液显
a.滴入酚酞溶液变红,再加入稀H2SO4红色退去
b.滴入酚酞溶液变红,再加入氯水红色退去
c.滴入酚酞溶液变红,再加入BaCl2溶液产生沉淀且红色退去
(3)化合物Cu2X和Cu2Z可发生如下转化(其中D是纤维素水解的最终产物):Cu2Z
澄清溶液
悬浊液
Cu2X
①D的化学式是
②Cu2X与浓硝酸反应有红棕色气体生成,则化学反应方程式是
(4)某温度下,在一个5L的密闭容器中充入0.2mol ZX2和0.1mol X2,20s后达到平衡,测得容器中含有0.18mol ZX3,则用X2表示该反应的平均速率是v(X2)=
查看习题详情和答案>>
(1)Z元素在周期表中的位置是
第三周期第ⅥA族
第三周期第ⅥA族
.(2)Y2ZX3溶液显
碱
碱
性,能证明该溶液中存在水解平衡的事实是c
c
(填序号).a.滴入酚酞溶液变红,再加入稀H2SO4红色退去
b.滴入酚酞溶液变红,再加入氯水红色退去
c.滴入酚酞溶液变红,再加入BaCl2溶液产生沉淀且红色退去
(3)化合物Cu2X和Cu2Z可发生如下转化(其中D是纤维素水解的最终产物):Cu2Z
| 浓硝酸 |
| 一定量NaOH |
| D的溶液 |
①D的化学式是
C6H12O6
C6H12O6
;②Cu2X与浓硝酸反应有红棕色气体生成,则化学反应方程式是
Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O
Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O
.(4)某温度下,在一个5L的密闭容器中充入0.2mol ZX2和0.1mol X2,20s后达到平衡,测得容器中含有0.18mol ZX3,则用X2表示该反应的平均速率是v(X2)=
9×10-4mol/(L?S)
9×10-4mol/(L?S)
,此温度下该反应的化学平衡常数K=4.05×104
4.05×104
. 图表法、图象法是常用的科学研究方法.
图表法、图象法是常用的科学研究方法.(Ⅰ)电离能是指由蒸气状态的孤立原子失去电子形成阳离子需要的能量.从中性原子中移去第一个电子所需要的能量为第一电离能(I1),移去第二个电子所需要的能量为第二电离能(I2),依次类推.
现有5种元素L、M、N、O、P,其I1~I3分别如下表,根据表中数据判断其中的金属元素有
M、N、O
M、N、O
,稀有气体元素是P
P
,最活泼的金属是M
M
,显二价的金属是O
O
.| 元 素 | I1/eV | I2/eV | I3/eV |
| L | 13.0 | 23.9 | 40.0 |
| M | 4.3 | 31.9 | 47.8 |
| N | 5.7 | 47.4 | 71.8 |
| O | 7.7 | 15.1 | 80.3 |
| P | 21.6 | 41.1 | 65.2 |
(1)该反应的化学方程式为
2P+3Q?2M
2P+3Q?2M
(2)若M、P、Q均为气体,反应达平衡时:
①体系的压强是开始时的
| 13 |
| 16 |
| 13 |
| 16 |
0.02mol/L?min
0.02mol/L?min
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应为
放热
放热
反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均分子量比原平衡时减小
减小
(填增大、减小或相等).(3)此反应达平衡后,若只加大体系压强,M的物质的量增加,若M是气体,则Q的聚集状态是
气态
气态
.短周期元素X、Y、Z原子序数依次递增。X、Y、Z的最外层电子数之和为13,Y是所在周期中金属性最强的,X、Z在同一主族。
(1)Z元素在周期表中的位置是 。
(2)Y2ZX3溶液显 性,能证明该溶液中存在水解平衡的事实是 (填序号)。
a.滴入酚酞溶液变红,再加入稀H2SO4红色退去
b.滴入酚酞溶液变红,再加入氯水红色退去
c.滴入酚酞溶液变红,再加入BaCl2溶液产生沉淀且红色退去
(3)化合物Cu2X和Cu2Z可发生如下转化(其中D是纤维素水解的最终产物):
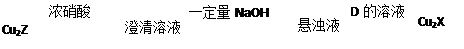
① D的化学式是 ;
② Cu2X与浓硝酸反应有红棕色气体生成,则化学反应方程式是 。
(4)某温度下,在一个5L的密闭容器中充入0.2 mol ZX2和0.1 mol X2,20 s后达到平衡,测得容器中含有0.18 mol ZX3,则用X2表示该反应的平均速率是v(X2) = ,此温度下该反应的化学平衡常数K= 。
查看习题详情和答案>>
图表法、图象法是常用的科学研究方法.
(Ⅰ)电离能是指由蒸气状态的孤立原子失去电子形成阳离子需要的能量.从中性原子中移去第一个电子所需要的能量为第一电离能(I1),移去第二个电子所需要的能量为第二电离能(I2),依次类推.
现有5种元素L、M、N、O、P,其I1~I3分别如下表,根据表中数据判断其中的金属元素有______,稀有气体元素是______,最活泼的金属是______,显二价的金属是______.
(Ⅱ)某温度时,在一个5L的密闭容器中,M、P、Q三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
(1)该反应的化学方程式为______
(2)若M、P、Q均为气体,反应达平衡时:
①体系的压强是开始时的______倍;从反应开始到平衡气体M的平均反应速率为______
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应为______反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均分子量比原平衡时______(填增大、减小或相等).
(3)此反应达平衡后,若只加大体系压强,M的物质的量增加,若M是气体,则Q的聚集状态是______.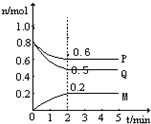
查看习题详情和答案>>
(Ⅰ)电离能是指由蒸气状态的孤立原子失去电子形成阳离子需要的能量.从中性原子中移去第一个电子所需要的能量为第一电离能(I1),移去第二个电子所需要的能量为第二电离能(I2),依次类推.
现有5种元素L、M、N、O、P,其I1~I3分别如下表,根据表中数据判断其中的金属元素有______,稀有气体元素是______,最活泼的金属是______,显二价的金属是______.
| 元 素 | I1/eV | I2/eV | I3/eV |
| L | 13.0 | 23.9 | 40.0 |
| M | 4.3 | 31.9 | 47.8 |
| N | 5.7 | 47.4 | 71.8 |
| O | 7.7 | 15.1 | 80.3 |
| P | 21.6 | 41.1 | 65.2 |
(1)该反应的化学方程式为______
(2)若M、P、Q均为气体,反应达平衡时:
①体系的压强是开始时的______倍;从反应开始到平衡气体M的平均反应速率为______
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应为______反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均分子量比原平衡时______(填增大、减小或相等).
(3)此反应达平衡后,若只加大体系压强,M的物质的量增加,若M是气体,则Q的聚集状态是______.

图表法、图象法是常用的科学研究方法.
(Ⅰ)电离能是指由蒸气状态的孤立原子失去电子形成阳离子需要的能量.从中性原子中移去第一个电子所需要的能量为第一电离能(I1),移去第二个电子所需要的能量为第二电离能(I2),依次类推.
现有5种元素L、M、N、O、P,其I1~I3分别如下表,根据表中数据判断其中的金属元素有______,稀有气体元素是______,最活泼的金属是______,显二价的金属是______.
(Ⅱ)某温度时,在一个5L的密闭容器中,M、P、Q三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
(1)该反应的化学方程式为______
(2)若M、P、Q均为气体,反应达平衡时:
①体系的压强是开始时的______倍;从反应开始到平衡气体M的平均反应速率为______
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应为______反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均分子量比原平衡时______(填增大、减小或相等).
(3)此反应达平衡后,若只加大体系压强,M的物质的量增加,若M是气体,则Q的聚集状态是______.
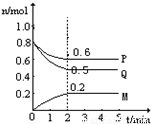 查看习题详情和答案>>
查看习题详情和答案>>
(Ⅰ)电离能是指由蒸气状态的孤立原子失去电子形成阳离子需要的能量.从中性原子中移去第一个电子所需要的能量为第一电离能(I1),移去第二个电子所需要的能量为第二电离能(I2),依次类推.
现有5种元素L、M、N、O、P,其I1~I3分别如下表,根据表中数据判断其中的金属元素有______,稀有气体元素是______,最活泼的金属是______,显二价的金属是______.
| 元 素 | I1/eV | I2/eV | I3/eV |
| L | 13.0 | 23.9 | 40.0 |
| M | 4.3 | 31.9 | 47.8 |
| N | 5.7 | 47.4 | 71.8 |
| O | 7.7 | 15.1 | 80.3 |
| P | 21.6 | 41.1 | 65.2 |
(1)该反应的化学方程式为______
(2)若M、P、Q均为气体,反应达平衡时:
①体系的压强是开始时的______倍;从反应开始到平衡气体M的平均反应速率为______
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应为______反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均分子量比原平衡时______(填增大、减小或相等).
(3)此反应达平衡后,若只加大体系压强,M的物质的量增加,若M是气体,则Q的聚集状态是______.
 查看习题详情和答案>>
查看习题详情和答案>>