网址:http://m.1010jiajiao.com/timu3_id_37437[举报]
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)某温度下,2SO2(g)+ O2(g) 2SO3(g);△H= mkJ·mol-1
K的大小与温度(T)的关系如右图中曲线所示,则m 0(填“>”“=”或“<”);
b点时v(正) v(逆)(填“<”、“>”或“=”)。反应的焓变(△H)将 (填“增大”、“减小”或“不变”)。
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填序号)。
(3)某硫酸厂利用S02尾气、废铁屑、空气、水合成绿矾(FeS04·7H20),反应中作还原剂的物质是 。
(4)将反应后的混合气体用氨水吸收可得到(NH4)2SO3和(NH4)2SO4两种化工原料
①对于(NH4)2SO3溶液,某同学写出了如下的正确关系式:
2[c(SO32-)+c(HSO3-)+c(H2SO3)]=c(NH4+)+c(NH3·H2O)
请分析该同学的依据是
②在(NH4)2SO4溶液中存在:NH4++H2ONH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,
![]() 的电离平衡常数Kb=1.7×10—5mol·L—1)
的电离平衡常数Kb=1.7×10—5mol·L—1)
(5)三氧化硫吸收后所得的硫酸常用来制备BaSO4作X射线透视时的内服造影剂,胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释) 。万一误服了少量BaCO3,应尽快用大量0.5mol/LNa2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为 mol/L(己知25℃时,Ksp(BaSO4)=l×10-10,Ksp(BaCO3)=1×l0-9)。
查看习题详情和答案>>
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)某温度下,2SO2(g)+ O2(g) 2SO3(g);△H=mkJ·mol-1
2SO3(g);△H=mkJ·mol-1
K的大小与温度(T)的关系如右图中曲线所示,则m 0(填“>”“=”或“<”);
b点时v(正) v(逆)(填“<”、“>”或“=”)。反应的焓变(△H)将 (填“增大”、“减小”或“不变”)。
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填序号)。

(3)某硫酸厂利用S02尾气、废铁屑、空气、水合成绿矾(FeS04·7H20),反应中作还原剂的物质是 。
(4)将反应后的混合气体用氨水吸收可得到 (NH4)2SO3和(NH4)2SO4两种化工原料
①对于(NH4)2SO3溶液,某同学写出了如下的正确关系式:
2[c(SO32-)+c(HSO3-)+c(H2SO3)]=c(NH4+)+c(NH3·H2O)
请分析该同学的依据是
②在(NH4)2SO4溶液中存在:NH4++H2O NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,
NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下, 的电离平衡常数Kb=1.7×10—5 mol·L—1)
的电离平衡常数Kb=1.7×10—5 mol·L—1)
(5)三氧化硫吸收后所得的硫酸常用来制备BaSO4作X射线透视时的内服造影剂,胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释) 。万一误服了少量BaCO3,应尽快用大量0.5mol/LNa2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为 mol/L(己知25℃时,Ksp(BaSO4)=l×10-10,Ksp(BaCO3)=1×l0-9)。
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)某温度下,2SO2(g)+
O2(g) 2SO3(g);△H= mkJ·mol-1
2SO3(g);△H= mkJ·mol-1
K的大小与温度(T)的关系如右图中曲线所示,则m 0(填“>”“=”或“<”);
b点时v(正) v(逆)(填“<”、“>”或“=”)。反应的焓变(△H)将 (填“增大”、“减小”或“不变”)。

(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填序号)。


(3)某硫酸厂利用S02尾气、废铁屑、空气、水合成绿矾(FeS04·7H20),反应中作还原剂的物质是 。
(4)将反应后的混合气体用氨水吸收可得到 (NH4)2SO3和(NH4)2SO4两种化工原料
①对于(NH4)2SO3溶液,某同学写出了如下的正确关系式:
2[c(SO32-)+c(HSO3-)+c(H2SO3)]=c(NH4+)+c(NH3·H2O)
请分析该同学的依据是
②在(NH4)2SO4溶液中存在:NH4++H2O NH3·H2O+H+,则该反应常温下的平衡常数K=
(已知:常温下,
NH3·H2O+H+,则该反应常温下的平衡常数K=
(已知:常温下, 的电离平衡常数Kb=1.7×10—5
mol·L—1)
的电离平衡常数Kb=1.7×10—5
mol·L—1)
(5)三氧化硫吸收后所得的硫酸常用来制备BaSO4作X射线透视时的内服造影剂,胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释) 。万一误服了少量BaCO3,应尽快用大量0.5mol/LNa2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为 mol/L(己知25℃时,Ksp(BaSO4)=l×10-10,Ksp(BaCO3)=1×l0-9)。
查看习题详情和答案>>
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)某温度下,2SO2(g)+ O2(g)![]() 2SO3(g);△H= mkJ·mol-1
2SO3(g);△H= mkJ·mol-1
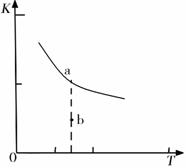
K的大小与温度(T)的关系如右图中曲线所示,则m 0(填“>”“=”或“<”);
b点时v(正) v(逆)(填“<”、“>”或“=”)。反应的焓变(△H)将 (填“增大”、“减小”或“不变”)。
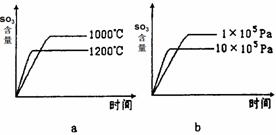
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填序号)。
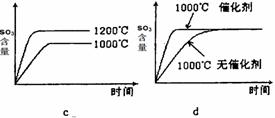
(3)某硫酸厂利用S02尾气、废铁屑、空气、水合成绿矾(FeS04·7H20),反应中作还原剂的物质是 。
(4)将反应后的混合气体用氨水吸收可得到 (NH4)2SO3和(NH4)2SO4两种化工原料
①对于(NH4)2SO3溶液,某同学写出了如下的正确关系式:
2[c(SO32-)+c(HSO3-)+c(H2SO3)]=c(NH4+)+c(NH3·H2O)
请分析该同学的依据是
②在(NH4)2SO4溶液中存在:NH4++H2O![]() NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,
NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,![]() 的电离平衡常数Kb=1.7×10—5 mol·L—1)
的电离平衡常数Kb=1.7×10—5 mol·L—1)
(5)三氧化硫吸收后所得的硫酸常用来制备BaSO4作X射线透视时的内服造影剂,胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释) 。万一误服了少量BaCO3,应尽快用大量0.5mol/LNa2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为 mol/L(己知25℃时,Ksp(BaSO4)=l×10-10,Ksp(BaCO3)=1×l0-9)。
查看习题详情和答案>>
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)某温度下,2SO2(g)+ O2(g)![]() 2SO3(g);△H= mkJ·mol-1
2SO3(g);△H= mkJ·mol-1
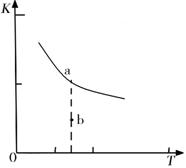
K的大小与温度(T)的关系如右图中曲线所示,则m 0(填“>”“=”或“<”);
b点时v(正) v(逆)(填“<”、“>”或“=”)。反应的焓变(△H)将 (填“增大”、“减小”或“不变”)。
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填序号)。
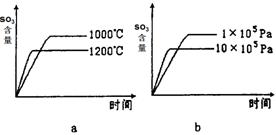
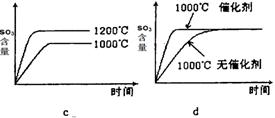
(3)某硫酸厂利用S02尾气、废铁屑、空气、水合成绿矾(FeS04·7H20),反应中作还原剂的物质是 。
(4)将反应后的混合气体用氨水吸收可得到 (NH4)2SO3和(NH4)2SO4两种化工原料
①对于(NH4)2SO3溶液,某同学写出了如下的正确关系式:
2[c(SO32-)+c(HSO3-)+c(H2SO3)]=c(NH4+)+c(NH3·H2O)
请分析该同学的依据是
②在(NH4)2SO4溶液中存在:NH4++H2O![]() NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,
NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,![]() 的电离平衡常数Kb=1.7×10—5 mol·L—1)
的电离平衡常数Kb=1.7×10—5 mol·L—1)
(5)三氧化硫吸收后所得的硫酸常用来制备BaSO4作X射线透视时的内服造影剂,胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释) 。万一误服了少量BaCO3,应尽快用大量0.5mol/LNa2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为 mol/L(己知25℃时,Ksp(BaSO4)=l×10-10,Ksp(BaCO3)=1×l0-9)。
查看习题详情和答案>>