摘要:21. (1)上表中的实线是元素周期表部分边界.请在表中用实线补全元素周期表边界. (2)元素甲是第三周期ⅥA族元素.请在右边方框中按氦元素(图1)的式样.写出元素甲的原子序数.元素符号.元素名称.相对原子质量和最外电子层排布. (3)元素乙的3p亚层中只有1个电子.则乙原子半径与甲原子半径比较: > . 甲.乙的最高价氧化物水化物的酸性强弱为: > . (4)元素周期表体现了元素周期律.元素周期律的本质是原子核外电子排布的 .请写出元素在元素周期表中的位置与元素原子结构的关系: .
网址:http://m.1010jiajiao.com/timu3_id_374250[举报]
(2006·上海)根据相关化学原理,下列判断正确的是
[ ]
A.若X是原子晶体,Y是分子晶体,则熔点:X<Y
B.若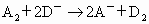 ,则氧化性:
,则氧化性: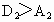
C.若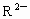 和
和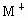 的电子层结构相同,则原子序数:R>M
的电子层结构相同,则原子序数:R>M
D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB
查看习题详情和答案>>(2008?上海,23)四种短周期元素的性质或结构信息如下表.请根据信息回答下列问题.
(1)B元素在周期表中的位置是
 .
.
(2)写出C单质与水反应的化学方程式
(3)D元素最高价氧化物晶体的硬度
(4)A、B两元素非金属性较强的是(写元素符号)
查看习题详情和答案>>
| 元素 | A | B | C | D |
| 性质或 结构 信息 |
室温下单质呈粉末状固体,加热易熔化;单质在氧气中燃烧,发出明亮的蓝紫色火焰 | 单质常温、常压下是气体,能溶于水;原子的M层上有7个电子 | 单质质软、银白色固体、导电性强;单质在空气中燃烧发出黄色的火焰 | 原子最外电子层有4个电子;单质为空间网状晶体,具有很高的熔、沸点 |
第三周期ⅦA族
第三周期ⅦA族
,写出A原子的电子式

(2)写出C单质与水反应的化学方程式
2Na+2H2O═2NaOH+H2↑
2Na+2H2O═2NaOH+H2↑
.A与C形成的化合物溶于水后,溶液的pH大于
大于
7(填“大于”“等于”或“小于”).(3)D元素最高价氧化物晶体的硬度
大
大
(填“大”或“小”),其理由是SiO2是原子晶体
SiO2是原子晶体
.(4)A、B两元素非金属性较强的是(写元素符号)
Cl
Cl
.写出能证明这一结论的一个实验事实高氯酸的酸性大于硫酸的酸性或氯化氢稳定性比硫化氢强
高氯酸的酸性大于硫酸的酸性或氯化氢稳定性比硫化氢强
. 据统计,2006年一季度江苏省粗钢产量为748.23万吨,同比增加254.86万吨;钢铁工业已成为我省重要的支柱产业.某大型铁矿附近有炼焦煤、石灰石、黏土矿和丰富的水资源.
据统计,2006年一季度江苏省粗钢产量为748.23万吨,同比增加254.86万吨;钢铁工业已成为我省重要的支柱产业.某大型铁矿附近有炼焦煤、石灰石、黏土矿和丰富的水资源.(1)随着铁矿的开发,该地建立了如图所示位置关系的炼焦厂、钢铁厂、发电厂和水泥厂.请写出图中B、D所代表的两个工厂的名称:B.
炼焦厂
炼焦厂
;D.水泥厂
水泥厂
.(2)硫铁矿其外观如黄金,故其又被称为“愚人金”.现有黄金、愚人金两种小块试样,提供的仪器主要有:
A.托盘天平 B.酒精喷灯 C.试管夹 D.坩埚钳 E.烧杯 F.量筒
另外,H2O、空气可任意选用,请回答问题:
①若用物理方法来鉴别该黄金、愚人金试样,应选用的仪器为
A、F
A、F
(填代号);②若用化学方法来鉴别该黄金、愚人金试样,应选用的仪器为
B、D
B、D
(填代号).(3)某发电厂每天排放1.12×103m3(标准状况)尾气,其中含0.02%(体积分数)的SO2,现欲用2.0 mol/L 氢氧化钠溶液进行处理,每天至少需要氢氧化钠溶液的体积是
5
5
L.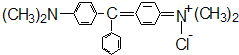 2006年11月17日,上海的一项抽检结果显示,申城市场上销售的多宝鱼药物残留超标现象严重,所抽样品全部被检出含有违禁药物氯霉素、硝基呋喃、孔雀石绿等.孔雀石绿的结构简式如图所示.下列关于孔雀石绿的说法不正确的是( )
2006年11月17日,上海的一项抽检结果显示,申城市场上销售的多宝鱼药物残留超标现象严重,所抽样品全部被检出含有违禁药物氯霉素、硝基呋喃、孔雀石绿等.孔雀石绿的结构简式如图所示.下列关于孔雀石绿的说法不正确的是( )| A、该物质在一定条件下能发生取代反应 | B、该物质中含有二个苯基 | C、该物质属于烃 | D、该物质的分子式为C23H25N2Cl |