摘要:已知A.B为常见金属.J是某主族元素的一种氧化物.该元素+2价比+4价稳定.相同物质的量的C和J分别与I在水溶液中反应时.消耗I的物质的量也相同.它们有下图所示的关系.试回答下列问题: ⑴写出化学式:B: ,L: ⑵写出反应方程式① ④ ⑶反应②在上世纪七十年代常用水银法替代生产.此法通过钠汞齐生产得到的烧碱质量号.浓度高.目前已被离子交换膜法所取代.两种生产方法示意图如下: 下列说法肯定不正确的是 A.水银法被淘汰.可能是时汞毒性大.易造成环境污染 B.水银法在电解槽中.阴极的电极反应式为:Na++e-+nHg== Na·nHg C.离子膜法电解.阳极发生的电极反应为2H+ + 2e- = H2 D.离子膜法烧碱在阴极生成.水银法烧碱在解汞槽中生成
网址:http://m.1010jiajiao.com/timu3_id_373845[举报]
已知A、B为常见金属,J是某主族元素的一种氧化物,该元素+2价比+4价稳定,相同物质的量的C和J分别与I在水溶液中反应时,消耗I的物质的量也相同。它们有下图所示的关系。试回答下列问题:

⑴写出化学式:B: ;L:
⑵写出反应方程式①
④
⑶反应②在上世纪七十年代常用水银法替代生产,此法通过钠汞齐(Na·nHg)生产得到的烧碱质量号,浓度高,目前已被离子交换膜法所取代。两种生产方法示意图如下:

下列说法肯定不正确的是 (选填A、B、C、D)
A、水银法被淘汰,可能是时汞毒性大,易造成环境污染
B、水银法在电解槽中,阴极的电极反应式为:Na++e—+nHg== Na·nHg
C、离子膜法电解,阳极发生的电极反应为2H+ + 2e— = H2
D、离子膜法烧碱在阴极生成,水银法烧碱在解汞槽中生成
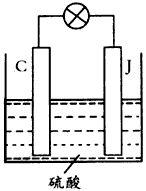
查看习题详情和答案>>已知D、H是常见的非金属单质,其中H是黄绿色气体.J是一种金属单质,J元素的+2价化合物比+4价化合物稳定.D、J元素在周期表中同主族,D是形成化合物种类最多的元素.A、C是金属氧化物,C和J均是某种常见电池的电极材料,B与C反应时,每生成1mol H同时消耗4mol B和1mol C.它们之间的关系如图:
(1)写出物质A的化学式
(2)写出反应②的化学方程式
(3)由金属氧化物A和C得到其相应的金属单质,在冶金工业上一般可用
①热分解法 ②热还原法 ③电解法
其中从A得到其相应金属也可以用铝热法,若反应中lmolA参加反应,转移电子的物质的量为
(4)用C、J作电极,与硫酸构成如图所示电池,工作时电池发生的总反应式为
(5)向框图中的红褐色透明液体K中逐滴滴入HCl溶液.可以观察到先产生红褐色沉淀,后红褐色沉淀溶解,请解释原因
查看习题详情和答案>>
(1)写出物质A的化学式
Fe3O4
Fe3O4
.(2)写出反应②的化学方程式
PbO2+4HCl=PbCl2+Cl2↑+2H2O
PbO2+4HCl=PbCl2+Cl2↑+2H2O
.(3)由金属氧化物A和C得到其相应的金属单质,在冶金工业上一般可用
②
②
方法(填序号).①热分解法 ②热还原法 ③电解法
其中从A得到其相应金属也可以用铝热法,若反应中lmolA参加反应,转移电子的物质的量为
8
8
mol.(4)用C、J作电极,与硫酸构成如图所示电池,工作时电池发生的总反应式为
Pb+PbO2+2H2SO4=2PbSO4+2H2O
Pb+PbO2+2H2SO4=2PbSO4+2H2O
,当反应转移1mol电子时,溶液中消耗H+的物质的量为2
2
mol.(5)向框图中的红褐色透明液体K中逐滴滴入HCl溶液.可以观察到先产生红褐色沉淀,后红褐色沉淀溶解,请解释原因
开始加盐酸时,氢氧化铁胶体遇电解质发生聚沉,再继续滴加则氢氧化铁沉淀与盐酸发生酸碱中和反应,沉淀溶解
开始加盐酸时,氢氧化铁胶体遇电解质发生聚沉,再继续滴加则氢氧化铁沉淀与盐酸发生酸碱中和反应,沉淀溶解

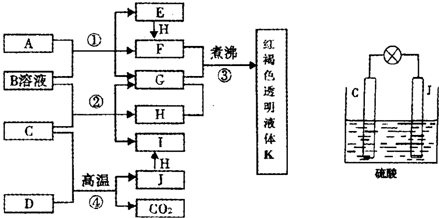
已知D、H是常见的非金属单质,其中H是黄绿色气体.J是一种金属单质,J元素的+2价化合物比+4价化合物稳定.D、J元素在周期表中同主族,D是形成化合物种类最多的元素.A、C是金属氧化物,C和J均是某种常见电池的电极材料,B与C反应时,每生成1mol H同时消耗4mol B和1mol C.它们之间的关系如图:
(1)写出物质A的化学式______.
(2)写出反应②的化学方程式______.
(3)由金属氧化物A和C得到其相应的金属单质,在冶金工业上一般可用______方法(填序号).
①热分解法 ②热还原法 ③电解法
其中从A得到其相应金属也可以用铝热法,若反应中lmolA参加反应,转移电子的物质的量为______mol.
(4)用C、J作电极,与硫酸构成如图所示电池,工作时电池发生的总反应式为______,当反应转移1mol电子时,溶液中消耗H+的物质的量为______mol.
(5)向框图中的红褐色透明液体K中逐滴滴入HCl溶液.可以观察到先产生红褐色沉淀,后红褐色沉淀溶解,请解释原因______
查看习题详情和答案>>
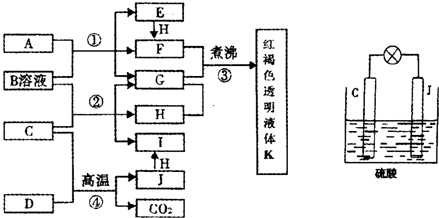
已知D、H是常见的非金属单质,其中H是黄绿色气体.J是一种金属单质,J元素的+2价化合物比+4价化合物稳定.D、J元素在周期表中同主族,D是形成化合物种类最多的元素.A、C是金属氧化物,C和J均是某种常见电池的电极材料,B与C反应时,每生成1mol H同时消耗4mol B和1mol C.它们之间的关系如图:
(1)写出物质A的化学式______.
(2)写出反应②的化学方程式______.
(3)由金属氧化物A和C得到其相应的金属单质,在冶金工业上一般可用______方法(填序号).
①热分解法 ②热还原法 ③电解法
其中从A得到其相应金属也可以用铝热法,若反应中lmolA参加反应,转移电子的物质的量为______mol.
(4)用C、J作电极,与硫酸构成如图所示电池,工作时电池发生的总反应式为______,当反应转移1mol电子时,溶液中消耗H+的物质的量为______mol.
(5)向框图中的红褐色透明液体K中逐滴滴入HCl溶液.可以观察到先产生红褐色沉淀,后红褐色沉淀溶解,请解释原因______
查看习题详情和答案>>
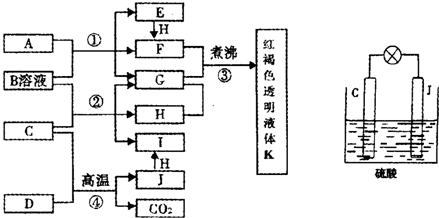
(1)写出物质A的化学式______.
(2)写出反应②的化学方程式______.
(3)由金属氧化物A和C得到其相应的金属单质,在冶金工业上一般可用______方法(填序号).
①热分解法 ②热还原法 ③电解法
其中从A得到其相应金属也可以用铝热法,若反应中lmolA参加反应,转移电子的物质的量为______mol.
(4)用C、J作电极,与硫酸构成如图所示电池,工作时电池发生的总反应式为______,当反应转移1mol电子时,溶液中消耗H+的物质的量为______mol.
(5)向框图中的红褐色透明液体K中逐滴滴入HCl溶液.可以观察到先产生红褐色沉淀,后红褐色沉淀溶解,请解释原因______

已知D、M、H是常见的非金属单质,其中M是无色气体,H是黄绿色气体。J是一种金属单质,J元素的+2价化合物比+4价化合物稳定。D、J元素在周期表中同主族,D是形成化合物种类最多的元素。A、C是金属氧化物,C和J 均是某种常见电池的电极材料,B与C反应时,每生成l mol H同时消耗4 moI B和1 mol C。它们之间的关系如图
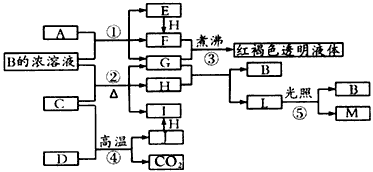
(1)写出物质A的化学式_________,CO2的电子式为_________。
(2)写出反应②的化学方程式______________________。
(3)向框图中的红褐色透明液体中逐滴滴入HI溶液,可以观察到先产生红褐色沉淀,后红褐色沉淀溶解,红褐色沉淀溶解的离子方程式为________________________。
(4)由金属氧化物A和C得到其相应的金属单质,在冶金工业上一般可用__________方法(填序号);
①热分解法②热还原法③电解法
其中从A得到其相应金属单质也可用铝热法,若反应中1 mol A参加反应,转移电子的物质的量为_______
mol。
(5)用C、J作电极,与硫酸构成如图所示电池,工作时电池的总反应式为_________________,当反应转移1 mol电子时,溶液中消耗H+的物质的量为____mol。
(2)写出反应②的化学方程式______________________。
(3)向框图中的红褐色透明液体中逐滴滴入HI溶液,可以观察到先产生红褐色沉淀,后红褐色沉淀溶解,红褐色沉淀溶解的离子方程式为________________________。
(4)由金属氧化物A和C得到其相应的金属单质,在冶金工业上一般可用__________方法(填序号);
①热分解法②热还原法③电解法
其中从A得到其相应金属单质也可用铝热法,若反应中1 mol A参加反应,转移电子的物质的量为_______
mol。
(5)用C、J作电极,与硫酸构成如图所示电池,工作时电池的总反应式为_________________,当反应转移1 mol电子时,溶液中消耗H+的物质的量为____mol。