网址:http://m.1010jiajiao.com/timu3_id_373798[举报]
已知A、B、C、D均为化合物,B、C常温常压下为气体,C气体可使湿润的红色石蕊试纸变蓝色;又知1 mol A在200℃时分解仅得1 mol B 和一定量的水两种产物,A中含有NO3-。A、B、C、D间有如下关系:
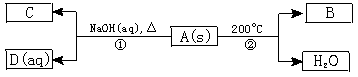
试回答下列问题:
(1)写出A、C的化学式:A 、C 。
(2)写出反应①的离子方程式:___________________。
(3)写出反应②的化学方程式,并标出电子的转移方向和数目:____________________。
查看习题详情和答案>>(1)写出A、C的化学式:A:______,C:______.
(2)D的电子式为______,D分子的结构呈______形.
(3)在反应①~③中,属于氧化还原反应的是______.
(4)反应②的化学方程式为:______;反应③的化学方程式为:______.

| |||||||||||||||||||||||
试回答:
(1)写出C的原子结构示意图


 ,你认为
,你认为(2)A、B两种元素组成的化合物很多,其中只含有一种类型共价键的化合物名称为
(3)这四种元素可组成多种原子个数比的化合物,其中属于离子晶体的化合物的化学式有
(4)A单质和C单质在一定条件下反应生成化合物E,E分子的空间结构为
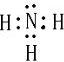
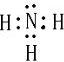
(1)下列叙述正确的是
a.M分子空间构型为平面三角形,而BD2为直线形,BA4为正四面体形
b.M和BD2分子中的中心原子均采取sp2杂化,而CA3分子中采取sp3杂化
c.N 是非极性分子,且分子中σ键 和π键的个数比为3:1
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(2)B、C、D三种元素的电负性由小到大的顺序为
(3)化合物CA3的沸点比化合物BA4的高,其主要原因是
(4)B、D、E三元素能形成化合物E(BD)5,常温下呈液态,熔点为-20.5℃,沸点为103℃.据此可判断E(BD)5晶体为
(5)化合物BD与元素B、C形成的阴离子互为等电子体,阴离子的化学式是