摘要:21.A.B.C.D.E为短周期元素.原子序数依次增大.其中A与E同主族.B的最外层电子数是次外层电子数的2倍.C的最高价氧化物对应的水化物与其氢化物反应生成一种盐X.A.B.D.E可组成化合物A2D2.B2A2.E2D2.它们都含有非极性共价键. (1)C元素在周期表中的位置是 .写出B的最高价氧化物的电子式 . (2)X的水溶液显 性.理由是 .溶液中各种离子浓度由大到小的顺序为 . (3)A.B.D.E四种元素组成的化合物中原子个数最少的化合物的化学式为 . (4)炎箭推进器中装有液态的C2A4和液态A2D2.它们发生化学反应时生成气态C单质和水蒸气.并放出大量热.已知0.4mol液态C2A4跟液态A2D2完全反应时.放出256.6kJ热量.该反应的热化方程式为 .
网址:http://m.1010jiajiao.com/timu3_id_373698[举报]
A、B、C、D、E为短周期元素,A到E原子序数依次增大,质子数之和为40;B,C同周期;A、D同主族;A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素.试回答:
(1)B元素在周期表中的位置为
(2)将D的单质投入A2C中,反应后得一种无色溶液,E的单质在该无色溶液中反应的离子方程式为
(3)A、C两元素可组成10电子粒子X-.Y与X-具有相同的原子种类及数目,且不带电,Y的电子式为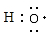
 .
.
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解.现改用A2C2和稀硫酸浸泡既达到了上述的目的,又保护了环境,试写出反应的化学方程式
查看习题详情和答案>>
(1)B元素在周期表中的位置为
第二周期第VA族
第二周期第VA族
.(2)将D的单质投入A2C中,反应后得一种无色溶液,E的单质在该无色溶液中反应的离子方程式为
2Al+2H2O+2OH-=2AlO2-+3H2↑
2Al+2H2O+2OH-=2AlO2-+3H2↑
.(3)A、C两元素可组成10电子粒子X-.Y与X-具有相同的原子种类及数目,且不带电,Y的电子式为


(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解.现改用A2C2和稀硫酸浸泡既达到了上述的目的,又保护了环境,试写出反应的化学方程式
H2O2+H2SO4+Cu=CuSO4+2H2O
H2O2+H2SO4+Cu=CuSO4+2H2O
.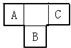 A、B、C、D、E为短周期元素,A、B、C在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.D与A同周期,其最高正价与最低负价代数和为零.A、E可形成AE3型分子,分子中只存在极性键.
A、B、C、D、E为短周期元素,A、B、C在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.D与A同周期,其最高正价与最低负价代数和为零.A、E可形成AE3型分子,分子中只存在极性键. (1)B元素在元素周期表中的位置是
第三周期VIA族
第三周期VIA族
.(2)C的离子结构示意图为




(3)由元素A、C及氢元素形成的化合物中含有的化学键的类型有
离子键、极性共价键
离子键、极性共价键
.(4)请设计一个实验来说明D与A的非金属性强弱(写出化学方程式即可)
2HNO3+Na2CO3=2NaNO3+H2O+CO2↑
(或其他合理方法)
(或其他合理方法)
2HNO3+Na2CO3=2NaNO3+H2O+CO2↑
(或其他合理方法)
.(或其他合理方法)
A、B、C、D、E为短周期元素,A-E原子序数依次增大,质子数之和为40,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素.
(1)B元素在周期表中的位置为
(2)将D的单质投入A2C中,反应后得到一种无色溶液.E的单质在该无色溶液中反应的离子方程式为
(3)元素D的单质在一定条件下,能与A单质化合生成氢化物DA,熔点为800℃.DA能与水反应放出氢气,化学反应方程式为
(4)废印刷电路版上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解.现改用A2C2和稀硫酸浸泡既达到了上述目的,又保护了环境,试写出反应的化学方程式
查看习题详情和答案>>
(1)B元素在周期表中的位置为
第二周期ⅤA族
第二周期ⅤA族
;(2)将D的单质投入A2C中,反应后得到一种无色溶液.E的单质在该无色溶液中反应的离子方程式为
2Al+2H2O+2OH-=2AlO2-+3H2↑
2Al+2H2O+2OH-=2AlO2-+3H2↑
;(3)元素D的单质在一定条件下,能与A单质化合生成氢化物DA,熔点为800℃.DA能与水反应放出氢气,化学反应方程式为
NaH+H2O=H2↑+NaOH
NaH+H2O=H2↑+NaOH
(4)废印刷电路版上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解.现改用A2C2和稀硫酸浸泡既达到了上述目的,又保护了环境,试写出反应的化学方程式
H2O2+H2SO4+Cu=CuSO4+2H2O
H2O2+H2SO4+Cu=CuSO4+2H2O
.A、B、C、D、E为短周期元素,其原子序数依次增大.其中,A元素原子半径最小;B元素原子的电子总数与最外层电子数之比为3:2;C元素最高价氧化物对应水化物与其氢化物反应生成一种盐甲.A、E同主族,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.请回答:
(1)写出B元素在周期表中的位置
 .
.
(2)常温下,甲的水溶液pH
(3)B、D、E组成的化合物丙,其水溶液pH大于7.则丙的组成可能是
(4)A和B组成化合物丁,其相对分子质量为16.将如图装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到量筒壁上有油状液滴生成等现象.油状液滴的成分是
(5)A、D、E组成的化合物乙与氯化亚铁溶液反应可用于制备Fe3O4.制备流程如下:

①写出步骤(Ⅰ)反应的离子方程式
②步骤(Ⅱ)的反应方程式是4Fe(OH)2+2H2O+O2═4Fe(OH)3,制备时应控制“一定量空气”的目的是
③由沉淀M获得Fe3O4的过程中发生的反应为
查看习题详情和答案>>
(1)写出B元素在周期表中的位置
第二周期、第ⅣA族
第二周期、第ⅣA族
,C单质的电子式是

(2)常温下,甲的水溶液pH
<
<
7(填“>、<或=”),其原因是(用离子方程式表示)NH4++H2O?NH3?H2O+H+
NH4++H2O?NH3?H2O+H+
.(3)B、D、E组成的化合物丙,其水溶液pH大于7.则丙的组成可能是
Na2CO3
Na2CO3
(填化学式).
(4)A和B组成化合物丁,其相对分子质量为16.将如图装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到量筒壁上有油状液滴生成等现象.油状液滴的成分是
CH2Cl2、CHCl3、CCl4
CH2Cl2、CHCl3、CCl4
(填化学式).(5)A、D、E组成的化合物乙与氯化亚铁溶液反应可用于制备Fe3O4.制备流程如下:

①写出步骤(Ⅰ)反应的离子方程式
Fe2++2OH-═Fe(OH)2↓
Fe2++2OH-═Fe(OH)2↓
.②步骤(Ⅱ)的反应方程式是4Fe(OH)2+2H2O+O2═4Fe(OH)3,制备时应控制“一定量空气”的目的是
控制O2的量,防止Fe(OH)2全部转化为Fe(OH)3
控制O2的量,防止Fe(OH)2全部转化为Fe(OH)3
.③由沉淀M获得Fe3O4的过程中发生的反应为
Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O
Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O
. A、B、C、D、E为短周期元素组成的中学常见物质,它们转化关系如图所示(部分产物、条件略去).下列说法正确的是( )
A、B、C、D、E为短周期元素组成的中学常见物质,它们转化关系如图所示(部分产物、条件略去).下列说法正确的是( )