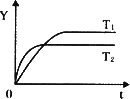
摘要:已知反应2SO2+O22SO3.△H<0.在恒温下的密闭容器中加入2molSO2和1molO2.达到平衡后.SO2的转化率为a.而在隔热密闭的同一容器中加入一样多的SO2和O2.达到平衡后.SO2的转化效率为b.若反应前两容器的温度相同.则a与b的正确关系为 A.a<b B.a>b C.a=b D.无法判断
网址:http://m.1010jiajiao.com/timu3_id_373637[举报]
|
已知反应2SO2(g)+O2(g)
| |
| [ ] | |
A. |
SO2的转化率 |
B. |
混合气体的密度 |
C. |
密闭容器内的压强 |
D. |
O2的体积分数 |
|
已知反应2SO2(g)+O2(g)
| |
| [ ] | |
A. |
SO2的转化率 |
B. |
混合气体的密度 |
C. |
密闭容器内的压强 |
D. |
O2的体积分数 |
在一个密闭容器中进行如下反应:2SO2(O)+O2(g) 2SO3(g),已知反应过程中某一时刻SO2、SO3和O2的浓度分别为0.2 mol·L-1、0.2 mol·L-1、0.1 mol·L-1,当反应达到平衡时可能的数据是( )
2SO3(g),已知反应过程中某一时刻SO2、SO3和O2的浓度分别为0.2 mol·L-1、0.2 mol·L-1、0.1 mol·L-1,当反应达到平衡时可能的数据是( )
A.c(SO2)=0.4 mol·L-1
B.c(SO2)=c(SO3)=0.15 mol·L-1
C.c(SO3)=0.4 mol·L-1
D.c(SO2)=0.25 mol·L-1
查看习题详情和答案>> (2012?淄博一模)硫及其化合物在国民生产中占有重要的地位.
(2012?淄博一模)硫及其化合物在国民生产中占有重要的地位.(1)为实现废旧印刷线路板综合利用,可用H2O2和稀H2SO4的混合液溶解处理产生的铜粉末,以制备硫酸铜.已知:
①Cu(s)+2H+(aq)+
| 1 | 2 |
②2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ?mol-1
Cu与H2O2和稀H2SO4的混合液反应生成Cu2+和H2O的热化学方程式为
H2O2(l)+Cu(s)+2H+(aq)=Cu2+(aq)+2H2O(l),△H=-319.68kJ/mol
H2O2(l)+Cu(s)+2H+(aq)=Cu2+(aq)+2H2O(l),△H=-319.68kJ/mol
;当有1molH2O2参与反应时,转移电子的物质的量为2
2
mol.(2)硫酸工业生产中涉及如下反应:2SO2(g)+O2(g)?2SO3(g).一定条件下,SO2的平衡转化率和温度的关系如图所示.该反应的△H
<
<
O(填“>”或“<”).反应进行到状态D时,v正>
>
v逆(填“>”、“<”或“=”).?(3)某温度时,将4molSO2和2molO2通入2L密闭容器中,10min时反应达到平衡状态,测得SO3的浓度为1.6mol?L-1,则0~10min内的平均反应速率v(SO2)=
0.16mol?L-1?min-1
0.16mol?L-1?min-1
,该温度下反应2SO2(g)+O2(g)?2SO3(g)的平衡常数K=80
80
. A、B、C和D均为短周期元素组成的非金属单质.其中B、C、D在常温下为气态,A为固体,W为含42个电子的离子化合物.它们满足如图的转化关系(反应条件略).
A、B、C和D均为短周期元素组成的非金属单质.其中B、C、D在常温下为气态,A为固体,W为含42个电子的离子化合物.它们满足如图的转化关系(反应条件略).(1)已知E为直线型的非极性分子,则E的结构式为
O═C═O
O═C═O
;D单质的电子式为

三角锥型
三角锥型
.(2)C+DG的化学方程式为
N2+3H2
2NH3
| ||
| 高温高压 |
N2+3H2
2NH3
.
| ||
| 高温高压 |
(3)已知短周期元素X与B中的元素位于同一主族,则X的最高价氧化物对应水化物的浓溶液与A反应的化学方程式为
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
.
| ||
(4)20℃时将G与E通入饱和食盐水中,有晶体析出,写出该反应的化学方程式
CO2+NH3+NaCl+H2O═NaHCO3↓+NH4Cl
CO2+NH3+NaCl+H2O═NaHCO3↓+NH4Cl
.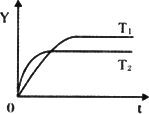
 2SO3(g);ΔH<O,向某体积恒定的密闭容器中按体积比2∶1充入SO2和O2,在一定条件下发生反应.下图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是
2SO3(g);ΔH<O,向某体积恒定的密闭容器中按体积比2∶1充入SO2和O2,在一定条件下发生反应.下图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是