网址:http://m.1010jiajiao.com/timu3_id_373470[举报]
A.向硝酸银溶液中滴加少量氨水 Ag++2NH3====[Ag(NH3)2]+
B.相同物质的量浓度、相同体积的FeI2溶液和溴水混合 2Fe3++2I-+2Br2====2Fe3++I2+4Br-
C.向硫酸氢钾溶液中加入少量氢氧化钾溶液 H++OH-====H2O
D.苏打与少量盐酸反应 ![]() +2H+====H2O+CO2↑
+2H+====H2O+CO2↑
①光导纤维、计算机芯片、太阳能电池板使用的材料主要是单晶硅
②天然的单质硅有无定形和结晶形两种形态
③等物质的量的铝、硅与足量NaOH溶液反应消耗NaOH的物质的量相等
④漂白液、漂白粉溶液中通入过量CO2反应的离子方程式相同
⑤金刚石、金刚砂、石英都是坚硬难熔的固体
⑥普通玻璃、水泥、陶瓷都是以含硅物质为原料,高温下生产的硅酸盐产品.
下列是某同学对相应反应的方程式所作的评价,其中评价合理的是( )
|
| A、A | B、B | C、C | D、D |
(14分)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍。又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)1 mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物反应生成两种盐和水,完全反应后消耗后者的物质的量为 。
(2)A、C、F间可以形成甲、乙两种负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(3)科学研究证明:化学反应热只与始终态有关,与过程无关。单质B的燃烧热为a kJ/mol。由B、C二种元素组成的化合物BC 14g完全燃烧放出热量b kJ,写出单质B和单质C反应生成BC的热化学方程式: ;
(4)工业上在高温的条件下,可以用A2C与BC反应制取单质A2。在等体积的I、II两个密闭容器中分别充入1 molA2C和1mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相等)。下列说法正确的是。
A.达到平衡所需要的时间:I>II B.达到平衡后A2C的转化率:I=II
C.达到平衡后BC的物质的量:I>II D.达到平衡后A2的体积分数:I<II
(5)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成化合物的溶液中构成电池,则电池负极反应式为 。
查看习题详情和答案>>
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。
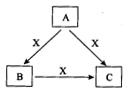
请针对以下不同情况回答:
(1)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①A中所含有的化学键是_____________。
②将4.48 L(标准状况下)X通入100mL3 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为_______________________________________。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________。
(2)若A为固态非金属单质,A与X同周期,常温常压下C为白色固体,B分子中各原子最外层均为8e![]() 结构。
结构。
①下列有关B物质的叙述正确的是
a、B的分子式为AX b、B为共价化合物
c、B分子呈三角锥形 d、B性质稳定,不与除X外的任何物质发生化学反应
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为 。
查看习题详情和答案>>