网址:http://m.1010jiajiao.com/timu3_id_37302[举报]
(1)工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g).实验测得CO2(g)和CH3OH(g)的浓度随时间变化如图1所示.

①从反应开始到平衡,氢气的平均反应速率v(H2)=
②图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是
③该反应的平衡常数K为
④500℃达平衡时,CH3OH的体积分数ω为
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为
Ⅱ.工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),其三步反应如下:
①2H2 (g)+CO(g)?CH3OH (g)△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2 (g)+H2(g)△H=-41.3kJ?mol-1
(3)总合成反应的热化学方程式为
(4)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是
A.高温高压 B.加入催化剂 C.减少CO2的浓度 D.增加CO的浓度 E.分离出二甲醚
(5)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/mol?L-1 | 0.44 | 0.60 | 0.60 |
(16分)Ⅰ.如何降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:
CO2(g)+3H2(g) 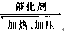 CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。 
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________________;
②图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是
热(填“吸”或“放”)反应。
③该反应的平衡常数K为 (保留两位小数)。若提高温度到800℃进行,达平衡时,K值 (填“增大”、“减小”或“不变”),
④500℃达平衡时,CH3OH的体积分数ω为 。
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为_________ ____ ___。
Ⅱ.工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),其三步反应如下:
1. 2H2 (g)+CO(g)  CH3OH (g) ΔH=-90.8 kJ·mol-1
CH3OH (g) ΔH=-90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
③ CO(g)+H2O(g)  CO2 (g)+H2(g) ΔH=-41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH=-41.3 kJ·mol-1
(3)总合成反应的热化学方程式为__________ _ 。
(4)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
| A.高温高压 |
| B.加入催化剂 |
| C.减少CO2的浓度 |
| D.增加CO的浓度 |
(5)已知反应②2CH3OH(g)
 CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| c / mol·L-1 | 0.44 | 0.60 | 0.60 |
(16分)Ⅰ.如何降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
。
CH3OH(g)+H2O(g)
。
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________________;
②图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是
热(填“吸”或“放”)反应。
③该反应的平衡常数K为 (保留两位小数)。若提高温度到800℃进行,达平衡时,K值 (填“增大”、“减小”或“不变”),
④500℃达平衡时,CH3OH的体积分数ω为 。
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为_________ ____ ___。
Ⅱ.工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),其三步反应如下:
② 2H2 (g)+CO(g)
 CH3OH (g)
ΔH= -90.8 kJ·mol-1
CH3OH (g)
ΔH= -90.8 kJ·mol-1
②
2CH3OH(g)  CH3OCH3(g)+H2O(g)
ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g)
ΔH= -23.5 kJ·mol-1
③
CO(g)+H2O(g)  CO2 (g)+H2(g)
ΔH= -41.3 kJ·mol-1
CO2 (g)+H2(g)
ΔH= -41.3 kJ·mol-1
(3)总合成反应的热化学方程式为__________ _ 。
(4)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
A.高温高压 B.加入催化剂 C.减少CO2的浓度
D.增加CO的浓度 E.分离出二甲醚
(5)已知反应②2CH3OH(g)  CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
c / mol·L-1 |
0.44 |
0.60 |
0.60 |
此时,v (正) _____ v (逆) (填“>”、“<”或“=”)。
查看习题详情和答案>>
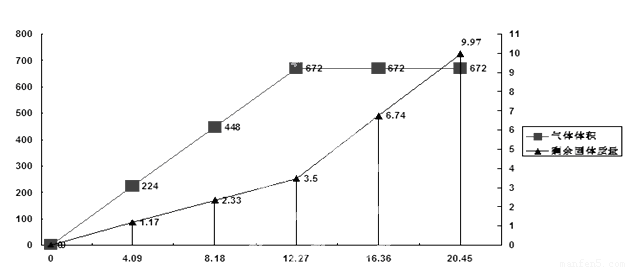
为检验一批因露置而部分变质的Ba(OH) 2药品的成分,某化学探究性学习小组设计了方案对其进行分析:将20.45g药品分成五等分,逐渐加入100mL1 mol/L的盐酸中,并充分搅拌,测得生成气体的体积(已换算为标准状况下)、剩余固体的量与固体加入量的关系如图所示。考虑到某地附近为硫酸工业区,该小组同学判断此药品可能含三或四种成分。
(1) 写出硫酸工业尾气与过量的Ba(OH) 2反应的离子方程式:????????????????????????
(2)提出以下三种合理假设:(已知在空气中Ba(OH) 2很难生成酸式盐)
假设一:药品成分为Ba(OH) 2和BaSO4、BaSO3;假设二:药品成分为Ba(OH) 2和________________;
假设三:药品成分为Ba(OH) 2和________________。
(3)实验验证:为确定该药品的成分,该小组利用上述实验中生成的气体,选择适当的试剂进行探究,请设计合理方案填入下表:
实验操作 | 预期实验现象和结论 |
| 若____________________,假设一成立;
若____________________,假设二成立;
若____________________,假设三成立。 |
(4)问题讨论:若经试验验证,此药品为四种成分混合物,该小组同学认为由上述曲线可知,当所加固体质量为12.27 g时,药品成分与盐酸刚好完全反应,你认为该组同学的判断是否正确______。(填“是”或者“否”)
查看习题详情和答案>>
(16分)Ⅰ.如何降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________________;
②图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是
热(填“吸”或“放”)反应。
③该反应的平衡常数K为 (保留两位小数)。若提高温度到800℃进行,达平衡时,K值 (填“增大”、“减小”或“不变”),
④500℃达平衡时,CH3OH的体积分数ω为 。
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为_________ ____ ___。
Ⅱ.工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),其三步反应如下:
① 2H2 (g)+CO(g)  CH3OH
(g) ΔH=
-90.8 kJ·mol-1
CH3OH
(g) ΔH=
-90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=
-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=
-23.5 kJ·mol-1
③ CO(g)+H2O(g)  CO2 (g)+H2(g) ΔH=
-41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH=
-41.3 kJ·mol-1
(3)总合成反应的热化学方程式为__________ _ 。
(4)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
A.高温高压 B.加入催化剂 C.减少CO2的浓度
D.增加CO的浓度 E.分离出二甲醚
(5)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数K
= 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K
= 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
c / mol·L-1 |
0.44 |
0.60 |
0.60 |
此时,v (正) _____ v (逆) (填“>”、“<”或“=”)。
查看习题详情和答案>>